2023年2月21日,再生元(Regeneron Pharmaceuticals, Inc.)宣布, FDA已受理优先审查Pozelimab(C5单抗)的生物制品许可申请(BLA),该申请用于治疗患有CHAPLE综合症的成人和1岁以下儿童。FDA确定的PDUFA日期为2023年8月20日。如果获得批准,Pozelimab将成为首个也是唯一一个治疗该疾病的药物。 此次受理的BLA申请得到了一项2/3期单臂临床试验(NCT04209634)结果的支持。该试验在10名1岁或以上的患者中研究Pozelimab的有效性和安全性。患者在第1天需静脉注射30mg/KG剂量水平的Pozelimab,随后每周根据体重皮下注射一定量Pozelimab。 试验结果如下: 在24周时,100%的患者实现了共同主要终点,血清白蛋白(一种疾病生物标志物)快速和持续地恢复正常,临床症状得到改善或没有恶化。评估的临床症状包括腹痛、每天的排便次数,以及研究者评估的面部和周边水肿。 不良事件(AEs)发生率为7/10,仅限于轻度或中度的不良事件,最常见的是缺铁、热射病、鼻炎、荨麻疹和呕吐。没有AE导致治疗中止。
| 关于CHAPLE病
CHAPLE病(又称CD55缺失所导致补体系统过度活化,血栓形成和蛋白质丢失性肠病)。直至2017年,研究人员才发现,CD55基因缺陷所导致的补体系统和固有免疫系统过度活化,是引起这一疾病的元凶。在大多数患者中,从婴儿期开始就会出现一系列潜在的危及生命的症状,包括腹痛、血性腹泻、呕吐、营养不良、生长缓慢、腿部肿胀(水肿)、反复感染以及致死性血栓。
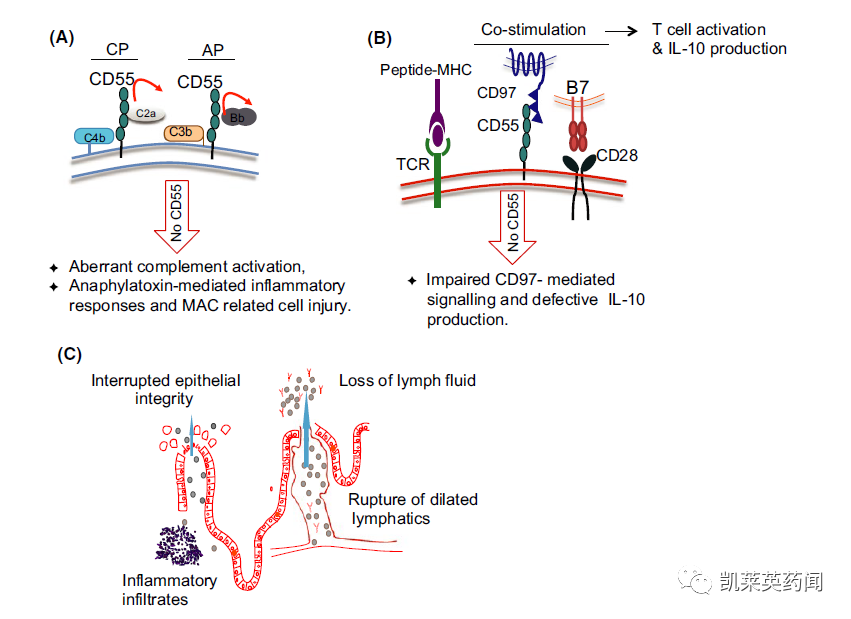
细胞膜上的CD55在经典和替代途径中抑制补体激活的传播
CHAPLE是一种超罕见的、危及生命的、由补体系统过度激活驱动的遗传性免疫疾病,目前还没有被批准的治疗方法。据统计,全世界已知患有CHAPLE的患者不到100人。
|关于Pozelimab
Pozelimab是利用Regeneron自主研发的VelocImmune®技术发明的一种研究性全人源单克隆抗体,旨在通过与补体因子C5结合,阻断补体信号通路,预防由补体途径介导的疾病。Pozelimab是一种IgG4抗体,已被证明能与野生型和变异型人类C5具有高度亲和力,并阻止其活性,显著减少血管内溶血。
作为其正在进行的开发计划的一部分,pozelimab还与Alnylam公司的cemdisiran(一款靶向补体C5蛋白的RNAi候选药物)联用,用于治疗其他补体介导的疾病,包括阵发性夜间血红蛋白尿症(PNH)和重症肌无力症(MG)。这种联合疗法目前正在处于III期临床研究阶段,预计2024年及以后提交BLA申请。

|关于VelocImmune® Technology
再生元的VelocImmune技术利用专有的基因工程小鼠平台,开展完全人单克隆抗体药物的开发。VelocImmune 有效且直接地从免疫小鼠中创建了大量候选抗体药物,快速创建与治疗靶点紧密结合的全人源抗体并避免含有非人源抗体(通常为鼠源)组件。
早在1985年,当Regeneron公司的联合创始人、总裁兼首席科学官George D. Yancopoulos还是一名研究生时,就开始设想制造这种基因人化源的小鼠。公司花了几十年时间开发VelocImmune及相关的VelociSuite®技术。
Yancopoulos博士和他的团队利用VelocImmune技术制造了目前所有原始的、经FDA批准的全人源单克隆抗体中的很大一部分。这包括REGEN-COV®(casirivimab和imdevimab)、Dupixent®(dupilumab)、Libtayo®(cemiplimab-rwlc)、Praluent®(alirocumab)、Kevzara®(sarilumab)、Evkeeza®(evinacumab-dgnb)和Inmazeb™(atoltivimab、maftivimab和odesivimab-ebgn)。
|关于Regeneron
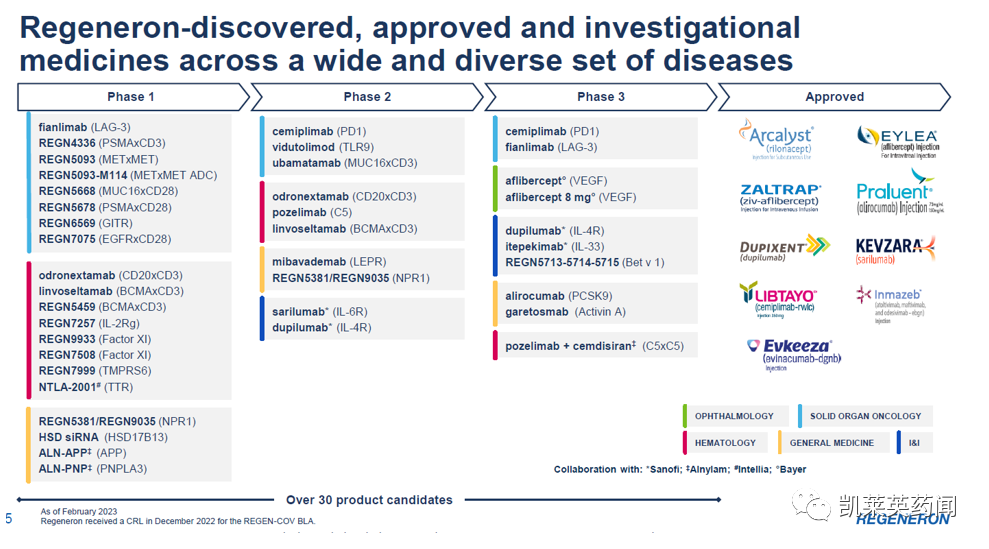
Regeneron是一家领先的生物技术公司,为患有严重疾病的人研发和生产相关药物。公司创立至今已有35年的历程,拥有Traps和VelociSuite两大技术平台,9款新药获FDA批准上市,30多款候选药物处于临床研究阶段,产品管线丰富。公司研发管线覆盖了眼科领域、心血管疾病领域、免疫和炎症领域、肿瘤和罕见病领域。