辉瑞宣布美国食品药品监督管理局(FDA)已授予其CD3/BCMA双特异性抗体elranatamab的生物制品许可申请(BLA)优先审评资格,预计FDA将在2023年对该申请做出决定。这也预示着,elranatamab有望继强生/Genmab的teclistamab之后,成为全球第二款获批上市的CD3/BCMA双特异性抗体。同时,欧洲药品管理局(EMA)也已接受了elranatamab的上市许可申请(MAA)。

Elranatamab旨在结合在多发性骨髓瘤 (MM) 细胞表面高度表达的BCMA和T细胞表面的CD3受体,激活T细胞以杀死骨髓瘤细胞。Elranatamab的BLA和MAA主要基于来自MagnetisMM-3 (NCT04649359) 队列A(BCMA-naïve,n=123)的数据,这是一项正在进行的开放、多中心、单臂II期临床研究,旨在评估elranatamab 单药治疗复发难治性多发性骨髓瘤 (RRMM)患者的安全性和有效性,纳入的患者此前接受过包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体等至少三类疗法治疗。
MagnetisMM-3研究中,患者每周接受一次皮下(SC)注射elranatamab (76mg,QW),周期为28天。接受6个或更多周期治疗并达到部分缓解或更好缓解至少2个月的患者,可调整给药间隔为每两周一次(Q2W)。
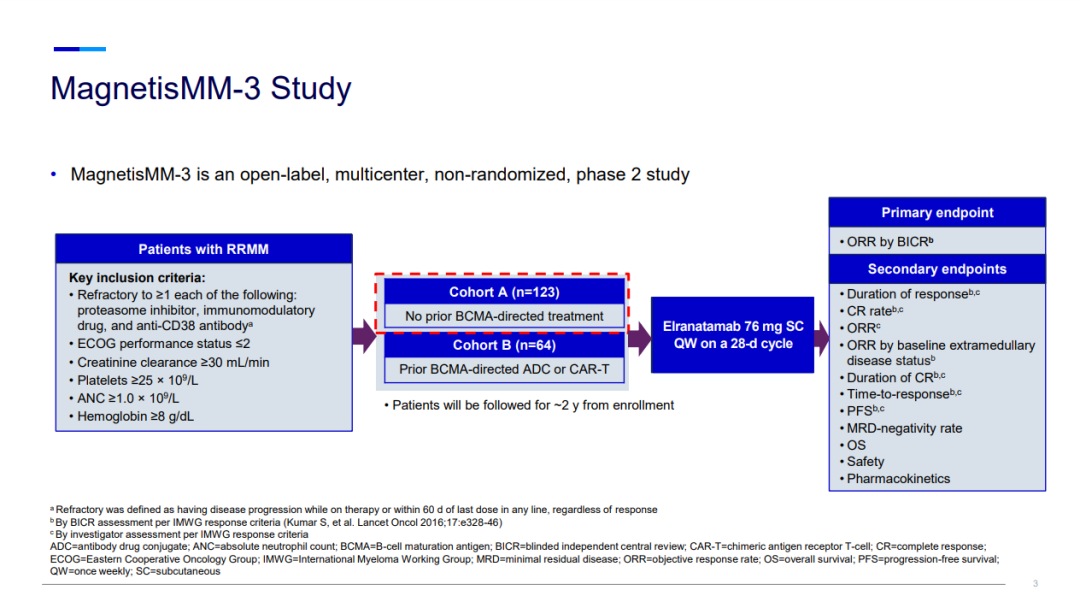
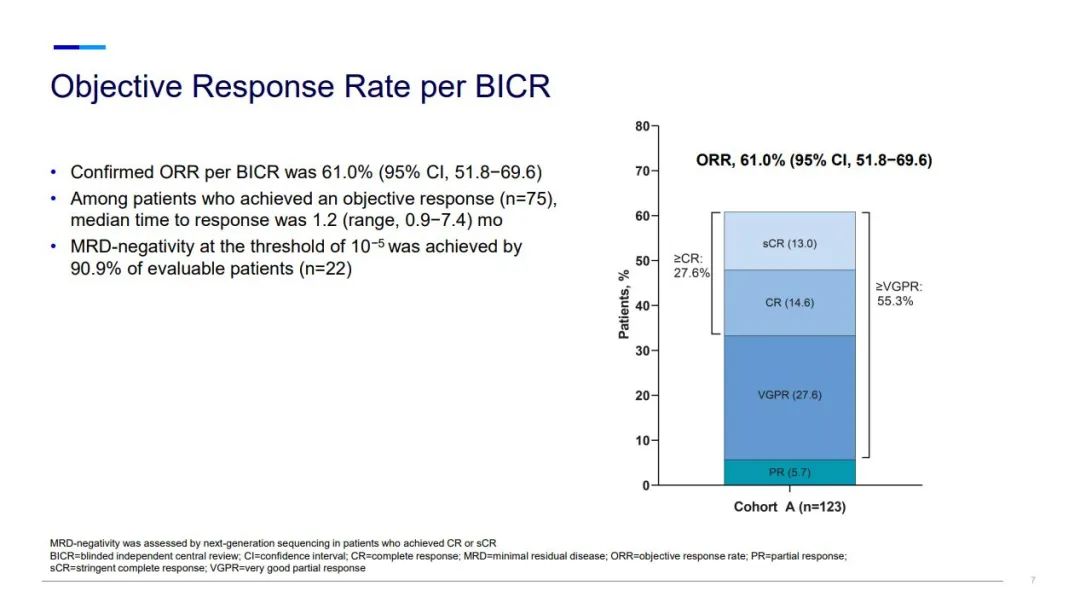
在中位随访10.4个月时,接受elranatamab作为首次BCMA靶向治疗的患者达到了61%的高客观缓解率以及55%的非常好的部分缓解率,MagnetisMM-3的结果还表明elranatamab具有可控的安全性。
2022年11月,辉瑞公司曾宣布elranatamab被FDA授予突破性疗法认定。此外,elranatamab已被FDA和EMA分别授予治疗MM的孤儿药物称号,以及快速通道指定和PRIME计划。英国药品和保健品监管局 (MHRA) 也授予elranatamab创新药物指定。FDA已将elranatamab纳入ORBIS项目,该项目是在多个国家同步提交和审评肿瘤产品的框架,可能会加快美国以外某些国家/地区的批准。