脊髓性肌萎缩症(SMA)是一种常染色体隐性神经肌肉疾病,由SMN1基因缺失导致运动神经元(SMN)蛋白存活水平降低引起。SMN2的选择性剪接将外显子7从大多数SMN2 pre-mRNA 转录本中排除,导致低水平的功能性 SMN 蛋白无法补偿 SMN1的损失。
介 绍
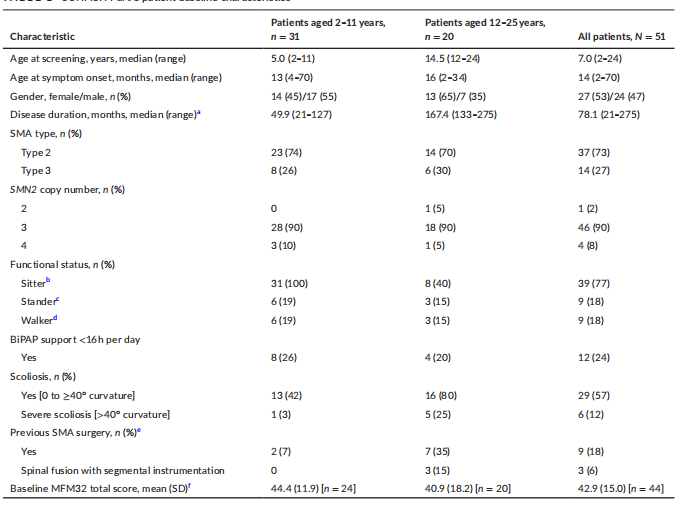
5q SMA以进行性运动功能丧失和肌无力为特征,包括根据达到的最高运动里程碑确定的5种亚型的广谱疾病。2型SMA在6-18个月大时出现症状:个体实现独立坐起的能力,可以在帮助下站立,但从不独立行走。3型SMA在18月龄后出现症状:个体能够独立站立和行走。 SMA有三种已批准的治疗:诺西那生钠是一种鞘内给药的SMN2 RNA靶向反义寡核苷酸,适用于治疗成人和儿童 SMA 患者;onasemnogene abeparvovec (Zolgensma)是一种静脉给药的腺病毒相关载体基因治疗,适用于治疗年龄 < 2岁的 SMA 患者,或治疗1型 SMA 患者或 SMN2 拷贝≤3个的患者;利司扑兰,一种口服给药的小分子SMN2剪接修饰剂,适用于治疗所有年龄。 SUNFISH是一项多中心、随机、双盲、安慰剂对照、两部分、II/III期研究,旨在评估利司扑兰在广泛的2型和3型SMA人群中的安全性、耐受性、药代动力学、药效学和疗效。第1部分是SUNFISH的剂量探索部分,评估不同剂量水平的安全性、耐受性以及 PK 和PD,以选择第2部分的利司扑兰剂量。第2部分研究了利司扑兰在选定剂量下对2型和非卧床3型SMA患者的疗效。 方 法 研究监督 SUNFISH 研究由伦理委员会批准,并按照法规和程序进行。在第1部分剂量发现期间,一个内部监测委员会(IMC)持续审查了数据。一个外部独立的数据监测委员会(iDMC)审查了数据,以确认IMC的剂量选择决定。在确认关键剂量后,将监测安全数据的责任转移给iDMC。 患者 入组患者年龄2-25岁,经基因确诊,临床症状为2型或3型SMA。 研究设计和结果 SUNFISH是在SMA患者中的第一个临床研究。SUNFISH第1部分的目的是评估利司扑兰给药后的安全性、耐受性、PK和PD,以确定第2部分中使用的关键剂量。 图1 设计方案 根据从入组患者中获得的PK数据,以剂量递增方式进行剂量探索,以达到方案规定的目标暴露量。第一步是达到700 ng·h/ml的血药浓度-时间曲线下面积(AUC)。一旦确定剂量达到该暴露量,且该暴露量显示安全且耐受良好,下一步是给予目标AUC为2000 ng·h/ml的剂量。目的是获得血液中SMN蛋白较基线至少增加2倍。在动物毒理学研究中,最高剂量下的利司扑兰暴露量不应超过平均AUC 2000 ng·h/ml的暴露量上限,以维持安全范围。 利司扑兰溶液以指定剂量每日一次经口给药。在每个剂量水平上,患者被随机接受双盲安慰剂或利迪普兰,为期至少12周。特定队列中的所有患者完成12周双盲治疗期后,在IMC审查所有数据后,接受安慰剂的患者在下一次计划访视时转换为利司扑兰。在选择第2部分的关键给药方案后,第1部分的所有患者均转换为关键剂量并继续治疗24个月。 安全性评估包括AE报告、实验室评估、心电图、人体测量和体格检查以及生命体征。由于在猴子的临床前研究中观察到对视网膜的影响,因此每2个月进行一次眼科评估。采集血液样本用于测定血浆中的SMN浓度和血液中的SMN蛋白。探索性功效终点包括运动功能和呼吸功能。 统计方法 使用描述性统计量总结所有安全性、SMN蛋白和疗效结果。安全性分析包括临床截止日期前至少24个月内收集的所有数据。所有患者均接受12个月和24个月治疗时进行探索性疗效分析;按总体人群和年龄组中截至CCOD的所有暴露量-风险双相期总结这些结果。 将MFM数据与外部对照药物进行比较,包括 NatHis-SMA研究中的患者和 WN29836 研究中安慰剂组的患者。NatHis-SMA是一项前瞻性、纵向研究,纳入未经治疗的2型和3型 SMA 患者,年龄2-30岁,患者人群与SUNFISH相似。研究WN29836是一项停药化合物olesoxime 的随机、双盲、安慰剂对照、2期研究,入组了3-25岁的SMA患者。为了纳入对照药物,这些研究的患者必须在基线和第12个月和/或第24个月时有可用的MFM总分。 结果 患者 所有入组的51例患者均完成至少12周的双盲、安慰剂对照期,然后以分配至其队列的剂量接受利司扑兰治疗。安慰剂对照期从19.1周到26.9周不等,因为特定队列中的所有患者仅在队列中最后一名患者完成12周且IMC审查所有数据后才转换为利司扑兰。3个2-11岁患者队列(A组)接受以下剂量水平:0.02、0.05、0.15和0.25 mg/kg。两个队列的12-25岁患者(B组)接受3和 5 mg 利司扑兰。在选择第2部分的关键剂量(体重≥20 kg的患者为5 mg,体重 < 20 kg的患者为0.25 mg/kg)后,所有患者均转换为关键剂量。 图2 SUNFISH 第1部分的患者基线特征 第1部分包括2型 (73%) 和3型 SMA(27%) 患者;大多数 (90%) 有3个SMN2拷贝。2-11岁和12-25岁患者的2型 SMA 患者比例相似。患者显示不同的基线运动功能。12%的患者患有严重脊柱侧凸,其中53%的患者在筛选前已经接受了脊柱侧弯手术。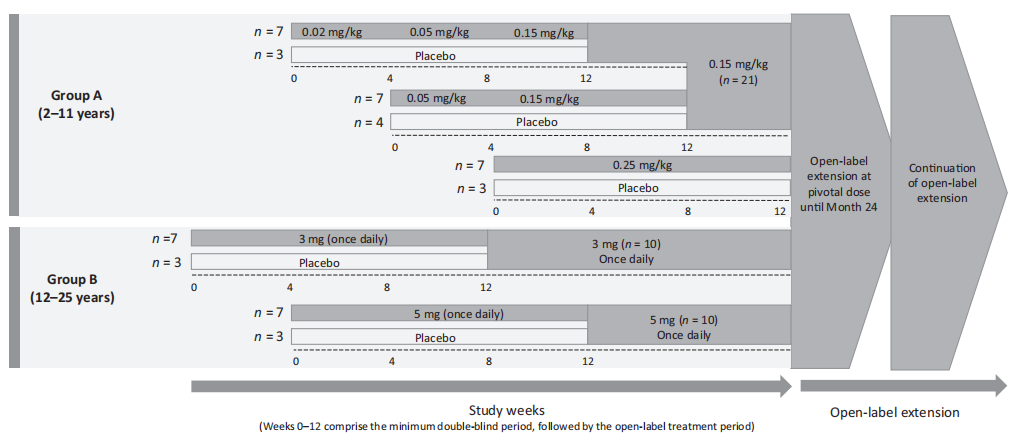
不良事件 安慰剂对照期 图3 至少12周、剂量探索、安慰剂对照期间发生的 AE 和 SAE 25例(71%)接受利司扑兰治疗的患者中报告了93例不良事件,11例(69%)接受安慰剂治疗的患者中报告了27例不良事件。六名 (17%) 接受利司扑兰治疗的患者和三名 (19%) 接受安慰剂治疗的患者报告了治疗相关的 AE (TRAE)。 利司扑兰治疗患者中最常见的AE按系统顺序分类为“感染及侵染类疾病”、“全身性疾病及给药部位各种反应”、“胃肠系统疾病”、“呼吸系统、胸及纵隔疾病”和“皮肤和皮下组织疾病”。 所有暴露量-风险比-双相治疗期 图4 在全暴露期间发生的不良事件和严重不良事件 最常见的 TRAE 为皮疹。所有其他 TRAE 各有1例患者报告,大多数 TRAE 在持续治疗期间消退。SAE 的发生率稳定,最常见的SAE为肺炎和股骨骨折。大多数AE的严重程度为轻度/中度。 PK和SMN蛋白 A组患者在初始分配的利司扑兰剂量0.02和0.05 mg/kg下观察到的PK数据低于预期。因此,IMC将剂量增加至0.15 mg/kg,以达到约700 ng·h/ml的预定目标暴露量。0.15 mg/kg剂量下实际观察到的中位暴露量为822 ng·h/ml。5 mg 和0.25 mg/kg剂量下的中位估计利司扑兰AUC分别为1610和1450 ng·h/ml。 治疗4周后观察到血液SMN蛋白呈剂量依赖性增加。在A组中,观察到安慰剂组患者降低7%,而0.02、0.05、0.15和0.25 mg/kg利司扑兰组患者分别增加9%、51%、67%和96%。在B组中,安慰剂组患者显示中位降低4%,而3 mg利司扑兰组增加125%,5 mg安慰剂组增加151%。在NatHis-SMA研究中,在最高剂量下观察到的SMN蛋白增加2倍在24个月内得以维持,而在未治疗患者中未随时间变化(图5)。 图5 SMN蛋白(从基线变化)超过24个月的关键剂量治疗。 在第1部分中,5 mg和0.25 mg/kg利司扑兰治疗达到了血液中SMN蛋白预期增加两倍的目标。PK模拟预测,对于体重≥20 kg的患者,每日一次5 mg给药方案的平均AUC≤2000 ng·h/ml,对于体重< 20 kg的患者,平均AUC为0.25 mg/kg。因此,选择该给药方案作为第2部分中检测的利司扑兰关键剂量。 探索性疗效措施 图6 12和24个月期间MFM32、RULM和 HFMSE 相对于基线的变化:利司扑兰治疗第24个月时,MFM32、RULM和HFMSE总分显示改善或稳定。在年轻患者中观察到运动功能改善更大。第24个月时,66.7%的2-11岁患者和47.4%的12-25岁患者的MFM32总分较基线显著改善≥3分。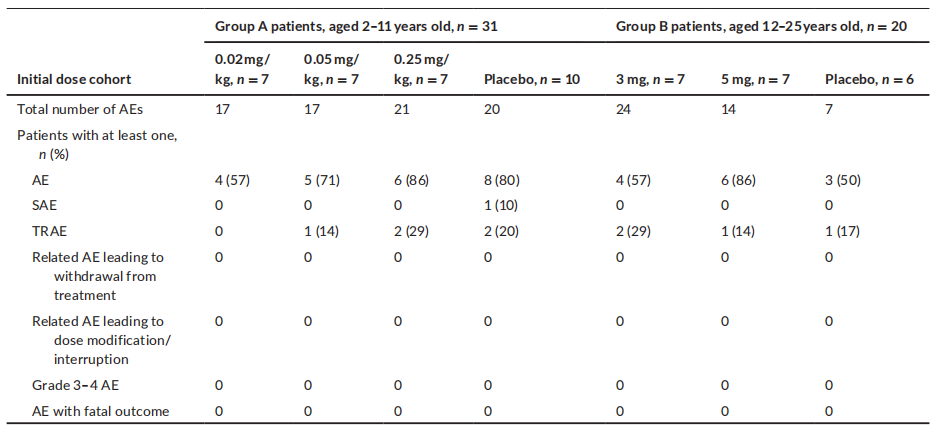
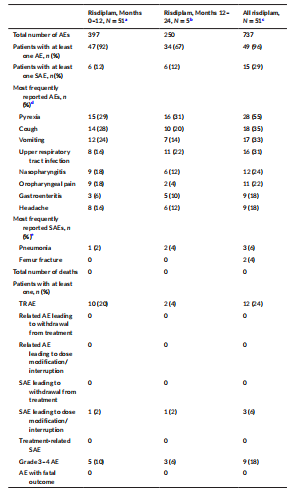
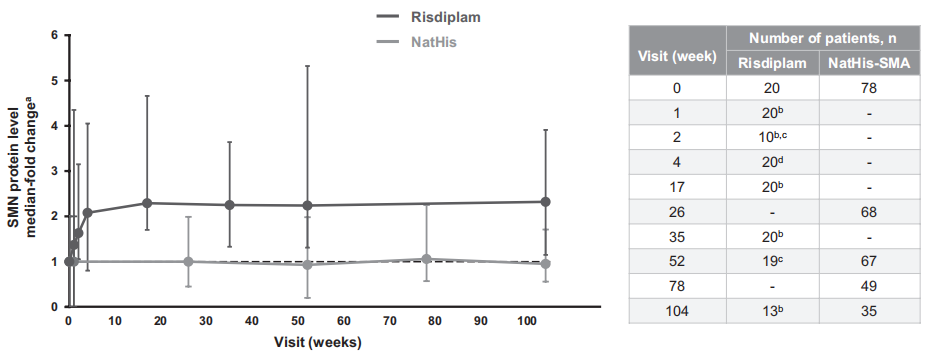
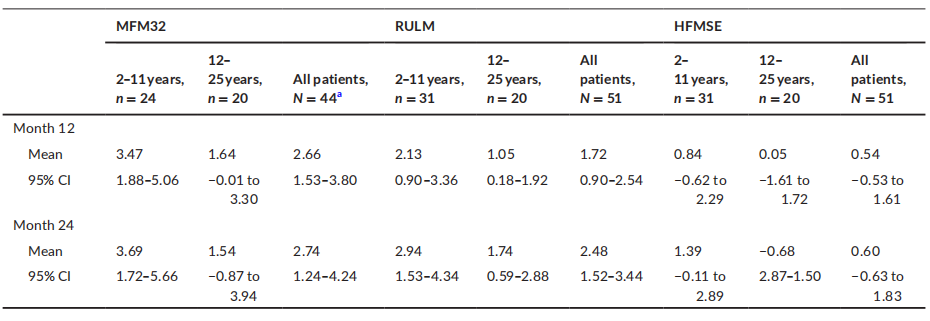
图7 与外部对照相比,24个月内运动功能测量 (MFM) 总分变化:SUNFISH第1部分人群的MFM总分较基线增加2.0,而外部对照药物降低2.0。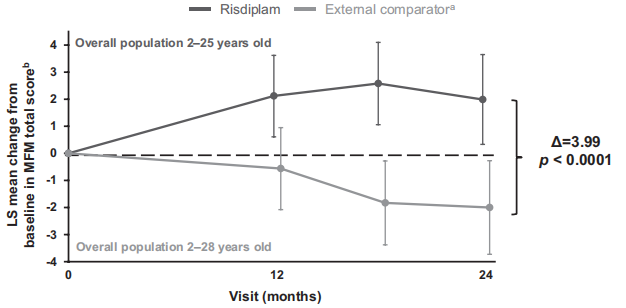
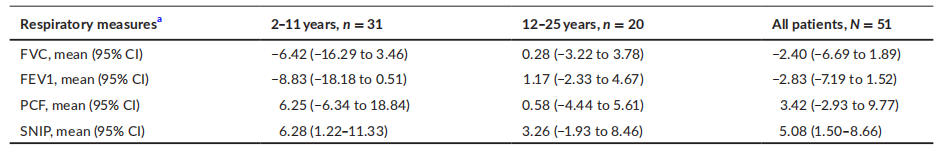
图8 第24个月时呼吸测量的百分比预测值与基线相比的变化:无临床显著变化 讨论 SUNFISH第1部分的目的是首次评估利司扑兰在SMA患者中的安全性、耐受性、PK和PD,并选择第2部分的关键剂量,即体重≥20 kg的患者5 mg和体重< 20 kg的患者0.25 mg/kg。在第1部分中,接受利司扑兰治疗长达31.9个月的任何患者均未出现导致退出的治疗相关安全性结果。 在接受利司扑兰的患者中未观察到动物研究中的非临床结果。在大鼠和家兔中的研究显示对胎仔发育有不良影响,如后代胚胎-胎仔死亡。本研究未评估利司扑兰对雄性生育能力和胎仔发育的影响。 2型和3型SMA的自然史包括疾病进展和功能持续丧失。在自然史队列中,24个月内 MFM32评分平均显著下降3.03。12个月内RULM评分平均下降0.41;改善主要见于< 5岁的儿童。24个月内HFMSE评分平均下降0.54。 探索性疗效分析显示,治疗24个月后,MFM32和RULM总分改善,HFMSE总分稳定。利司扑兰组与对照药物组之间的差异为3.99分。3分被认为是显著改善,代表获得新功能或几种功能改善,表明治疗24个月后运动功能有意义的改善。既往自然史研究显示,24个月内HFMSE 评分降低,突出了运动功能稳定的重要性。患者调查显示,稳定是SMA患者的重要治疗目标,并被认为是在这一人群中的一个积极的结果。研究显示,年轻患者显示所有探索性疗效终点的改善更大。 SUNFISH 第1部分在2型和3型SMA患者中表现出良好的安全性特征,进一步支持在该人群中开展利司扑兰研究。治疗导致血液 SMN 蛋白水平持续升高。第1部分的患者进入3年扩展期,定期监测安全性、耐受性和疗效。在第2部分中,正在患者中评估利司扑兰的长期有效性。