近日,BioMarin宣布其用于治疗血友病A的AAV基因疗法Roctavian(valoctocogene roxaparvovec)3期临床再获积极结果,且本试验的随访时间已超过了3年。根据新闻稿指出,这也是规模最大,持续时间最长的血友病基因疗法全球3期临床试验。

血友病分为A 、B两型。A型血友病是凝血因子VIII(FVIII)缺乏所导致的出血性疾病,约占先天性出血性疾病的85%,发病率大约是B型血友病的4倍。目前,对这一疾病的标准疗法是每周进行2-3次预防性因子VIII替代疗法,虽可一定程度控制病程,但仍有出血风险,也给患者带来许多副作用和很大的经济负担。
Roctavian是一款通过使用AAV5病毒载体递送表达凝血因子VIII的转基因的基因疗法,其优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达凝血因子VIII,从而不再需要长期接受预防性凝血因子注射。
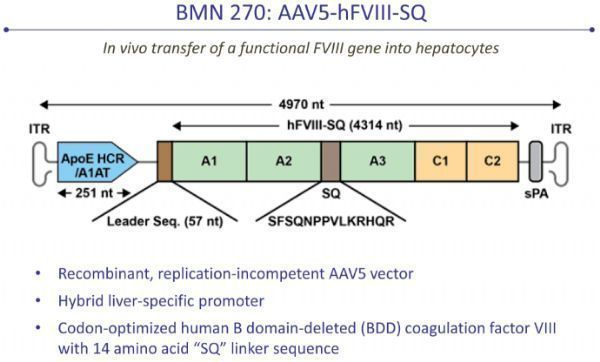
Roctavian(图源:BioMarin官网)
根据本次公布的3期随访数据显示,在接受Roctavian治疗3年和4年的患者中,其凝血因子VIII的活性平均值分别为18.8和15.2,中位数值为8.4和7.4。两组的平均年出血事件率分别为1.0和0.8,而中位值都为0.0。
此外,两组的年凝血因子平均使用次数分别为8.4和11.1,中位值也均为0。新闻稿指出,与基线值相比,在治疗的第三年后,患者的平均年出血事件率减少了80%,而凝血因子VIII的使用减少了94%。同时,该公司指出,在第3年时,92%的患者仍然不需要预防性治疗。
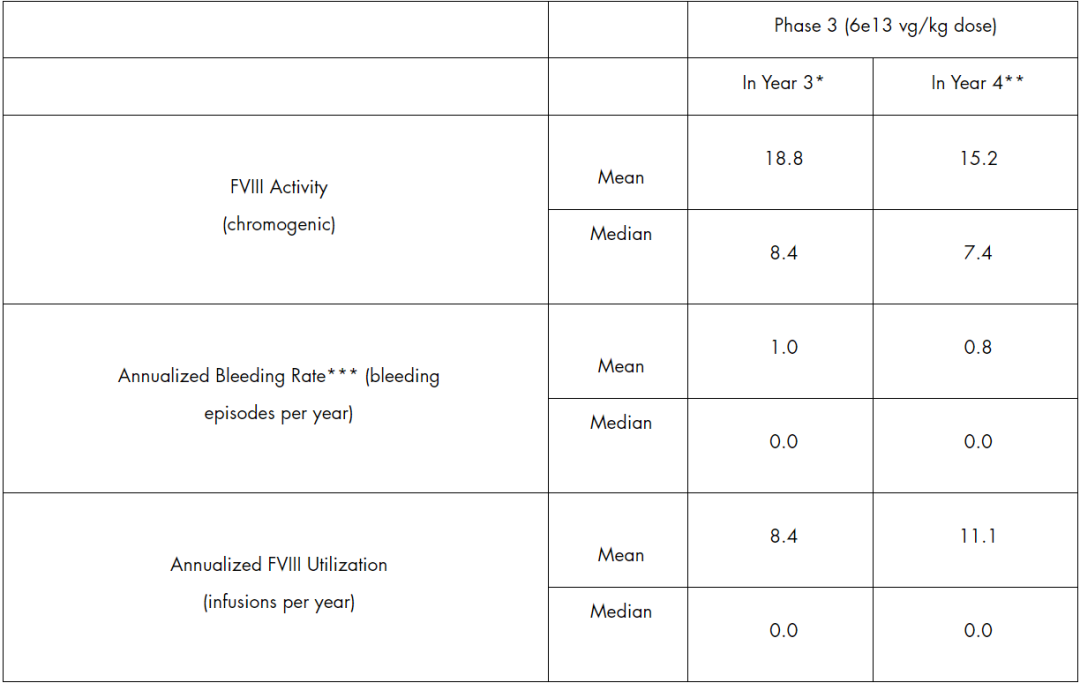
Roctavian 3期临床3年以及4年随访结果(图源:BioMarin官网)
2022年8月,Roctavian已在欧盟批准上市,用于治疗体内不含凝血因子VIII抑制物和AAV5抗体的重度A型血友病成人患者。此次批准,也使得Roctavian成为首款治疗血友病A的获批基因疗法。此外,欧盟还保持了该疗法的孤儿药认定并授予其10年市场独占期。
事实上,Roctavia上市进程并不平坦,BioMarin公司自2014年启动该药物的IND,用了近十年的时间才将它成功推入欧洲市场,但至今还未获得FDA批准。早在2019年,该公司就已向FDA提交了Roctavian的BLA,但在2020年8月遭到FDA拒批,原因在于BioMarin所公布的1/2期研究数据中,平均年化出血率(ABR)有所波动,且患者体内的因子VIII水平在持续下降,FDA认为这需要更完整的随访数据。
出于此次受挫,BioMarin也愈发谨慎,在2020年11月主动向EMA提出撤回Roctavian的上市申请,又于2021年6月重新提交了上市申请。
不可否认,随着随访时间的加长,人们对Roctavian疗效下降的担忧越来越明显。而FDA拒批,要求BioMarin提供3期临床的更长随访数据,也意味着监管机构对该基因疗法的持久性也仍存在疑虑。
从BioMarin的I/II期临床随访数据中确实可以看到凝血因子活性持续下降的趋势,在Roctavian注射后第一,二,三,四,五年,患者的平均FVIII活性水平分别为64.3,36.4,32.7,24.2和11.6 IU/dL。而结合本次公开的最新随访数据,在随访一至四年的III期临床研究中,FVIII活性水平也同样出现了一致的下降(第一年42.8 IU/dL,第二年23.0 IU/dL,第三年18.8 IU/dL以及第四年15.2 IU/dL)。
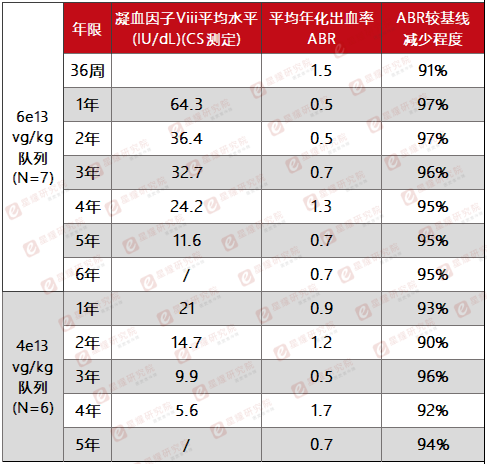
1/2期研究关键数据汇总(图源:星耀研究院)
从以上关键随访数据对比,可以看到随着时间的增长,FVIII活性水平确有下降,但也不难观察到FVIII表达水平的下降速度有所减缓趋势。同样令人出乎意料的是,即使FVIII的水平降到了预设值之下,对自然出血的抑制功能也依然存在。这一现象也表明其治疗效果与凝血因子VIII在体内的活性水平或存在某种联系,但并不意味着其疗效会随FVIII活性水平下降而消失。正如BioMarin所说,我们对这款基因疗法的持久性需要重新认识。
值得一提的是,Roctavian在2022年8月获EMA批准上市后,于10月12日,FDA已再次受理了BioMarin重新提交的上市申请。此外,2022年11月23日,FDA对Roctavian的BLA的审查也取得积极的进展,FDA将不再计划召开咨询委员会会议来讨论Roctavian的BLA。FDA为其亮起“绿灯”的这一举措也将意味着Roctavian的上市之路可能会更加顺利。
而在本次的3期结果中,BioMarin已依照FDA的要求,进行了全部出血类型的年出血事件分析(无论是否使用外源凝血因子VIII进行治疗)。结果显示,3年和4年的平均值分别为1.4和1.6,中位值分别为0.0和1.0。BioMarin公司表示,这些结果将会分享给FDA,作为监管审核材料的一部分。
不管怎么说,Roctavian已获FDA受理,这一积极回应也说明FDA对该款基因疗法的肯定。我们有理由相信,这一全球首款血友病A基因疗法将会在今年给更多患者带去希望!
参考资料:
1.https://www.biospace.com/article/releases/biomarin-announces-stable-and-durable-annualized-bleed-control-for-roctavian-in-largest-phase-3-gene-therapy-study-in-adults-with-severe-hemophilia-a-134-participant-study-met-all-primary-and-secondary-efficacy-endpoints-at-3-year-analysis/