2022年1月,诺华在中国递交的SMA基因治疗药物OAV101注射液(Zolgensma)获得临床试验许可。Zolgensma是一款基于AAV载体的基因疗法,此基因疗法用scAAV9载体经静脉输注将正常SMN1基因导入患者体内,产生正常的SMN1蛋白,从而改善运动神经元等受累细胞的功能。其静脉注射于2019年5月获美国FDA批准上市,用于2岁以下1型SMA患者,尚未在中国获批上市。
2022年4月19日,上海朗昇生物科技有限公司宣布,公司产品LX101注射液用于治疗RPE65双等位基因突变相关的遗传性视网膜变性(IRD)患者的临床试验申请,已获得中国国家药品监督管理局药品审评中心(CDE)批准。RPE65基因突变引起的遗传性视网膜变性(Inherited retinal degenerations,IRD),是一种典型的致盲性罕见病。患者婴幼儿期发病,通常经历严重、进行性的视网膜退化和视觉功能恶化,几乎所有患者最终进展为完全失明。
2022年4月20日,国家药品监督管理局(NMPA)药品审评中心官网显示,上海天泽云泰生物医药有限公司自主研发的首个基因替代疗法药物VGB-R04注射液正式获得NMPA临床试验默示许可,适应症为先天性凝血因子FIX缺乏引起的血友病B。
VGB-R04于2021年12月获得美国FDA的孤儿药认定(ODD),这也是首个中国自主研发用于血友病B的体内基因治疗产品获得该认定,VGB-R04注射液获临床试验的默示许可,将为血友病B患者带来更多治疗选择的可能性。
2022年6月21日,国家药品监督管理局药品审评中心(CDE)官网显示,杭州嘉因生物自主研发的基因疗法“EXG001-307注射液”临床试验申请获得批准,适应症为I型脊髓型肌萎缩症(SMA I型),伴有存活运动神经元1(SMN1)基因的双等位基因突变(缺失)。这是国内首款针对I型SMA患者自主研发的基因疗法,其与诺华已上市的SMA基因疗法Zolgensma的作用机制和用法均相似,是一种新型的治疗1型SMA的基因替代疗法,有望实现一次给药长期有效。
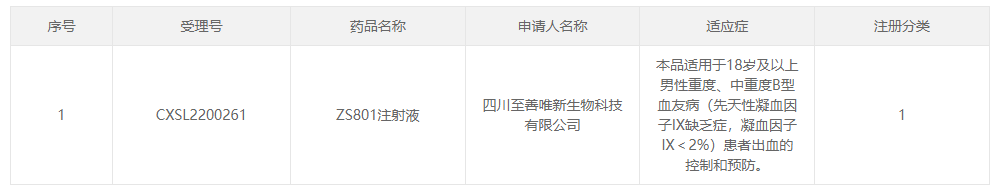
2022年8月30日,中国国家药品监督管理局药品评审中心(CDE)公示,四川至善唯新生物科技有限公司(以下简称“至善唯新”)“ZS801注射液”临床试验的申请获得默示许可(受理号:CXSL2200261)。适用于18岁及以上男性重度、中重度B型血友病(先天性凝血因子IX缺乏症,凝血因子IX<2%)患者出血的控制和预防。这是国内首个B型血友病原创靶标基因药物,标志着中国腺相关病毒载体(rAAV)基因药物治疗再获重要里程碑。据悉,ZS801是一种rAAV基因药物,与传统酶替代疗法相比,有望实现“一针治愈”
2022年9月,国家科学技术部政务服务平台公布了2022年第17批中国人类遗传资源行政事项审批结果,其中一项名为“一项开放标签、单中心、剂量递增临床研究,评价FT-002视网膜下腔给药对RPGR基因变异相关的X连锁视网膜色素变性男性受试者的安全性、耐受性和初步有效性”的AAV基因疗法通过中国科技部遗传办审批。该项目是由BioBAY园内企业方拓生物申办,是国内首项针对X连锁视网膜色素变性(XLRP)患者的重组腺相关病毒(rAAV)基因疗法临床研究。
2022年10月,北京锦篮基因科技有限公司研发的AAV基因治疗药物GC101腺相关病毒注射液(以下简称“GC101注射液”)获得临床试验默示许可(受理号:CXSL2200324),注册分类为1类,临床适应症为“1型脊髓性肌萎缩症(1型SMA)”。11月15日,GC101注射液获得国家药品监督管理局药品审评中心临床试验默示许可(受理号:CXSL2200400),用于2型SMA患者的治疗用药。基因药物GC101注射液是一种携带正常SMN1基因表达单元的重组9型腺相关病毒载体(AAV9),通过鞘内注射方式一次性给药,使SMN1基因在运动神经元细胞表达,从而改善运动神经元等受累细胞的功能,辅以呼吸及运动康复训练,可以改善提高SMA患者呼吸功能及运动能力。
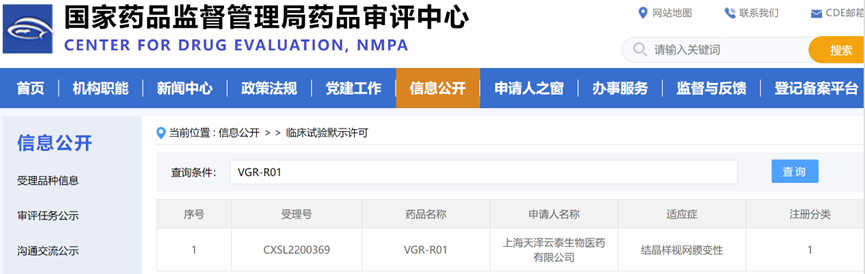
2022年11月1日,上海天泽云泰生物医药有限公司(以下简称“天泽云泰”)自主研发的VGR-R01注射剂临床试验(IND)申请获得国家药品监督管理局药品审评中心(CDE)默示许可。VGR-R01是针对CYP4V2基因突变导致的结晶样视网膜变性(Bietti crystalline dystrophy, BCD)患者的基因替代疗法药物,也是继今年7月VGB-R04注射液获批以来天泽云泰的第二款获得临床许可的基因治疗产品。
12月6日,国家药监局药品审评中心(CDE)官网公示,中因科技申报的ZVS101e注射液获得临床试验默示许可,拟开发适应证为结晶样视网膜变性(携带CYP4V2双等位基因突变)。ZVS101e注射液是一款基因替代疗法药物,此前已经获得美国FDA授予孤儿药资格。
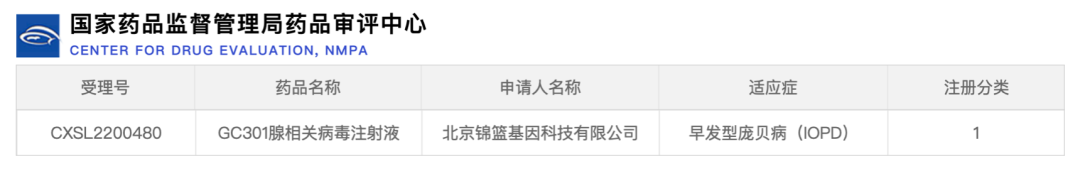
2022年12月20日,锦篮基因研发的用于治疗庞贝病的AAV基因治疗药物获得国家食品药品监督管理局药品审评中心许可开展临床试验。该药品名称为GC301腺相关病毒注射液,受理注册号CXSL2200480,临床适应症为早发型庞贝病(Pompe disease)。GC301注射液是锦篮基因设计开发的用于治疗庞贝病的AAV基因治疗药物,采用了一次性静脉注射全身广泛表达的策略,以期直接补偿肝脏、心肌、骨骼肌、中枢神经系统等组织的GAA酶基因缺陷。这也是国际上首个获批正式临床试验的早发型庞贝病AAV基因治疗药物。本文根据国家药监局药品审评中心、各企业官网公布信息整理,如有遗漏或错误,欢迎各位读者补充或指正。