近日,博雅辑因宣布其针对输血依赖型β地中海贫血的基因编辑造血干细胞在研产品ET-01的多中心I期临床试验已完成最后一例患者输注。谈到地贫的基因治疗,首先想到的必然是今年8月蓝鸟生物在美获批上市的慢病毒基因疗法beti-cel(商品名:Zynteglo)。但事实上,目前在治疗地贫的基因疗法中,进展更快的候选产品多是源自于CRISPR基因编辑路线。据不完全统计,全球已有5款针对地贫的基因编辑疗法进入临床研究阶段,其中进度最快的CTX001已经到II/III期,准备递交滚动上市申请。
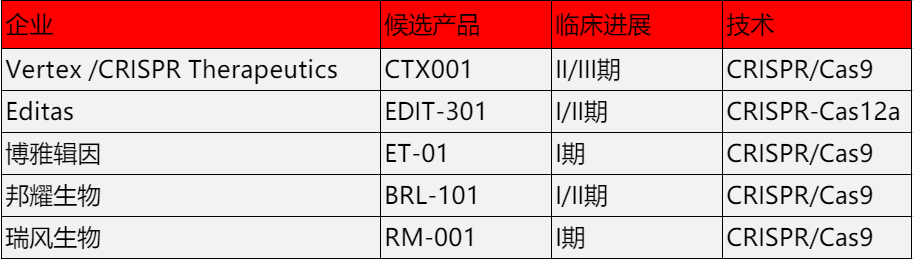
临床阶段治疗地贫的基因编辑候选产品
目前针对β地中海贫血的治疗方法大致可分为两类。第一类为用携带有正常β血红蛋白基因的慢病毒感染患者造血干细胞(慢病毒整合)。第二类为利用CRISPR等技术对患者造血干细胞基因组进行修改(基因编辑)。
慢病毒整合的方式虽已有产品上市,但基于人们对慢病毒整合的方法仍存在潜在插入突变的安全性问题以及巨额的花费等方面的担忧,使得业界对基因编辑疗法寄予厚望,以期为患者带来一种可能成本更低、耐久性更佳的治疗选择。
那么,在地贫领域,基因编辑是否成为未来主要趋势,与慢病毒疗法相较有何差异,其疗效是否又更胜一筹?
慢病毒基因疗法
一直以来,慢病毒基因疗法总是避不开其安全性问题,即随机整合的风险。就如首款获批治疗地贫的beti-cel也曾因为载体安全性问题几经起伏,直到今年8月才得以成功上市。但抛开慢病毒载体安全性,疗效方面beti-cel似乎已经给出了初步答案。
beti-cel的III期试验结果显示,89% (32/36)所有年龄和基因型的可评估患者(包括年仅4岁的儿童和最严重基因型 (β0/β0)患者均实现了输血独立)至少12个月不再需要RBC输注,同时保持至少9g/dL平均Hb水平。这一可观的疗效或许就是蓝鸟最大的筹码,以及其天价背后的底气。
除了蓝鸟生物,国内本导基因、禾沐基因、康霖生物等企业也在此领域有所布局,并都得了积极的早期临床结果。对标蓝鸟的beti-cel,这些企业纷纷采取了不同的技术优化,以攻克细胞干性受损、价格高昂、周期时长等可及性问题。
2021年12月,本导基因宣布,其与中国人民解放军联勤保障部队第九二〇医院合作开展的“慢病毒载体转导自体CD34+造血干细胞治疗输血依赖型β-地中海贫血的安全性和有效性研究”的临床实验已取得初步成效,接受治疗的患者经过3个月的随访已初步摆脱输血。这也是国内首次报道基于慢病毒载体基因转导技术治疗β-地中海贫血的成功案例。
今年11月15日,禾沐基因与深圳大学总医院合作的“HGI-001注射液治疗输血依赖型β地中海贫血(成人)临床研究”启动会成功召开。HGI-001作为禾沐基因重点开发的第一序列产品,在2020年12月一项由研发者发起临床研究中已成功帮助4位儿童输血依赖型β地贫患者长期脱离输血,脱离输血最长者迄今已达21个月(截至2022年11月15日)。四例受试者中,接受治疗后血红蛋白最高者可达136g/L。已有的临床数据表明,对于儿童输血依赖型β重症地贫患者,HGI-001注射液治疗效果显著,不存在免疫排斥,且未发现与HGI-001注射液相关的显著副作用,这些数据展示了HGI-001较好的安全性和有效性。
此外,康霖生物针对β地贫基因治疗候选产品KL-003已在临床试验中取得了令人振奋的结果,成功治愈2名重症患者。在18岁以下患者中的临床试验数据显示,粒细胞植入时间分别为10天和15天(蓝鸟生物为平均25.25天,范围:16-38天),血小板植入时间分别为14天和19天(蓝鸟生物为平均超过50.5天,范围:20-94天),初步展现了KL-003较好的疗效和安全性。
CRISPR基因编辑疗法
基因编辑疗法因其有望规避慢病毒随机整合可能带来的致癌风险而备受业界关注。在蓝鸟生物Zynteglo上市之际,9月27日,Vertex Pharmaceuticals与CRISPR Therapeutics联合宣布,将从2022年11月开始向FDA滚动提交其CRISPR细胞治疗候选产品exa-cel(CTX001)的BLA,并预计将在2023年第一季度末完成提交。这意味着如若exa-cel顺利获批,我们也将迎来全球首款获FDA批准上市治疗地贫的CRISPR药物。
那么,与慢病毒基因疗法相较,基因编辑疗法疗效与安全性又如何?
2022年6月,CRISPR Therapeutics公布了exa-cel最新数据,44名接受exa-cel治疗的TDT患者平均HbF显着增加,平均总血红蛋白(Hb)相应增加,平均总Hb水平在第3个月增加到>11g/dL并得到维持。其中,有42名患者不再需要输血(随访时间为1.2-37.2个月),其余2名患者的输血量减少了75%和89%。
在安全性方面,44例TDT患者中,有2例患者有被认为与exa-cel相关的严重不良事件(SAE),但均已消退,31例SCD患者中未出现与exa-cel相关的SAE。
2022年11月3日,博雅辑因宣布将于第64届美国血液学会(ASH)年会上以海报形式展示在研疗法ET-01基于研究者发起临床研究的初步安全性和有效性数据。
研究表明,单次输注ET-01可显著而持久地提高胎儿血红蛋白水平,受试者在接受ET-0输注后3个月开始脱离输血,截至2022年5月20日已实现脱离输血15个月,且数据显示ET-01的安全性与自体造血干细胞移植和清髓预处理安全性一致。该数据进一步验证了ET-01治疗输血依赖型β地中海贫血患者的安全性和有效性,支持ET-01开展针对β地中海贫血患者的后续临床试验研究。
2022年8月4日,邦耀生物宣布,其与中南大学湘雅医院合作的世界首例CRISPR基因编辑治疗β0/β0型重度地贫的患儿目前脱离输血依赖已超过2年,开启了正常生活和学习,该项临床试验成果已在国际顶级医学学术期刊Nature Medicine发表。

数据显示,截至文章投稿时,两名患儿的胎儿血红蛋白分别从基线时的2.55g/L、1.75g/L分别上升至最近一次访视的149g/L和139g/L,总血红蛋白含量也分别达到了152g/L和140g/L,且在治疗后都实现了脱离输血依赖超过16个月(脱离输血依赖的定义为:未输血的情况下总血红蛋白达到或超过90g/L)。在整个治疗过程中,清髓预处理相关毒性较轻,未发生严重的感染,并分别于移植后52天和40天出院。
2022年11月17日,瑞风生物宣布将在ASH年会以海报形式公布早期探索性临床研究中5例接受RM-001治疗的地贫患者的临床观察数据。数据显示,所有5位患者均在接受RM-001产品治疗后一个月内停止输血,随访至今8-11个月,疗效稳定,RM-001的安全性与自体造血干细胞移植和清髓预处理安全性一致,且未发生严重不良事件,患者健康状况良好,均已回归正常的生活。
从以上临床数据可以看出,不管是慢病毒基因疗法还是体外基因编辑疗法,其疗效均可圈可点,都让我们看到了β地中海贫血被完全治愈的希望,但都存在一定的安全隐患。基因编辑同样也存在许多质疑的声音,如脱靶问题,DNA双链断裂隐患以及免疫原性等。
客观来说,慢病毒与基因编辑尽管都是提升血红蛋白水平和红细胞功能,但所用策略却存在一些本质区别。这些差异到底是否会表现为患者的不同疗效和反应、基因编辑是否能体现比慢病毒策略更高的安全性?这些都要在将来长期随访和跟踪中去观察,两种治疗方式到底谁更经得起考验,时间会给出答案。
基因疗法的开发本就是一个长期的过程,期待不久的将来,地中海贫血患者可以得到更为全面有效的治疗。
参考资料:
1.https://xueqiu.com/4376152234/232466341