Intellia Therapeutics在2022年美国过敏、哮喘和免疫学学院 (ACAAI) 年会上公布了其在研体内CRISPR/Cas9候选疗法NTLA-2002的1/2期临床研究的最新中期数据,用于治疗遗传性血管水肿(HAE)。结果显示,接受NTLA-2002治疗的HAE成人病患血浆激肽水平大幅度下降且HAE发作次数降低,NTLA-2002具有功能性治愈HAE的潜力。

HAE是一种罕见的遗传性疾病,其特征主要表现为身体各器官和组织发生严重、反复和不可预测的炎症发作。HAE常由于补体C1抑制物(C1-INH)缺陷或功能障碍导致局部肿胀和疼痛。目前,针对HAE的治疗需要患者通过每周2次的长期静脉或皮下给药,或每日口服给药等途径进行终生治疗,但依然面临疾病突然发作的风险。
Intellia的体内编辑疗法NTLA-2002是一种全身性给药的疗法,旨在通过LNP递送CRISPR/Cas9系统,对激肽释放酶B1基因(KLKB1)进行基因组编辑,从而特异性关闭KLKB1基因的表达,永久性降低激肽释放酶水平,以达到治愈HAE的目的。在今年九月,该疗法获得FDA孤儿药资格认定。
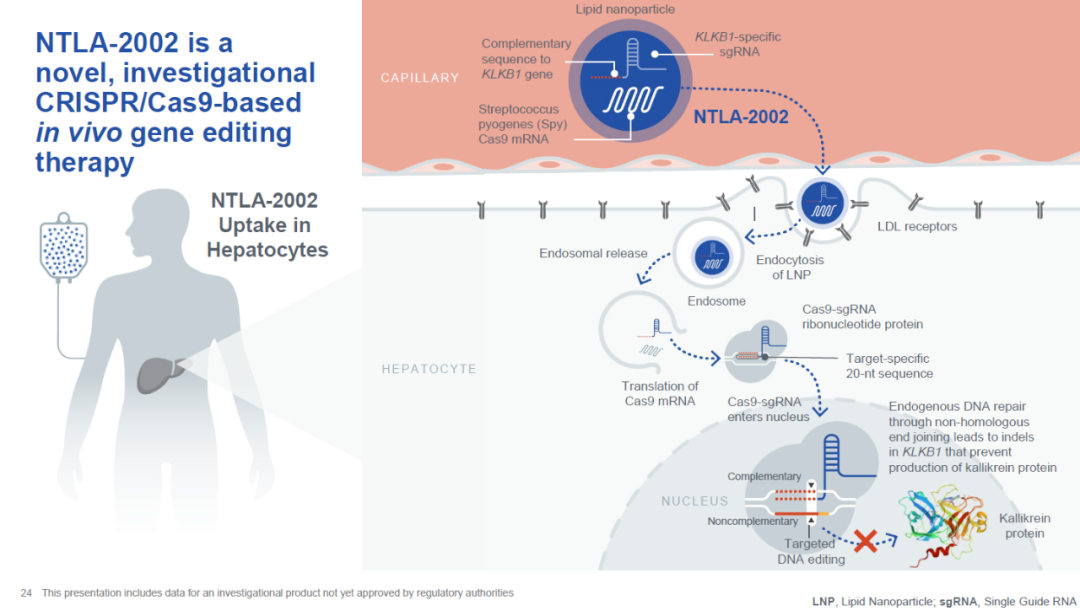
NTLA-2002的作用机制(图片来源:Intellia公司官网)
此次最新数据基于一项包含10名HAE成年患者的1期剂量递增临床研究。截至2022年9月28日,10例受试者分别接受 25mg(n=3)、50mg(n=4)和75mg(n=3)单剂量的NTLA-2002静脉注射,并测量每位患者血浆激肽释放酶蛋白基线值的变化。
疗效方面:在所有测试剂量下,患者血浆激肽释放酶水平和HAE发作率均显著降低。与基线相较,接受25 mg与75 mg剂量的病患,平均激肽水平下降幅度为64%与92%,且分别持续了32与16周;此外,25 mg剂量组的患者在单次给药后5.5~10.6个月无发作。

HAE患者血浆激肽水平临床数据(图片来源:参考资料1)
迄今为止,25 mg和 75 mg剂量组中的所有患者均已达到初始观察期的终点。该两组患者在第1周至第16周平均HAE发病率分别降低91%和78%。目前,50 mg 剂量组中的患者尚未完成 16周观察。

HAE患者发作率临床数据(图片来源:参考资料1)
安全性方面:NTLA-2002在三个剂量水平下均表现出良好的耐受性,大部分不良事件为轻度,最常见的为输液相关反应,且在一日内减缓。迄今为止,未观察到剂量限制性毒性、严重不良事件和3级以上不良反应。
基于以上数据可以看到NTLA-2002为HAE患者提供功能性治愈的巨大潜力。该公司预计将选择两种剂量,以安慰剂为对照、剂量扩大的2期试验中进一步评估NTLA-2002疗效,此项研究预计在2023年上半年开始。
NTLA-2001治疗ATTR获积极数据
Intellia作为基因编辑领域的明星企业,基于CRISPR/Cas9技术,该公司针对Ex Vivo(离体)与In Vivo(在体)基因治疗建立了针对罕见遗传疾病、感染性疾病、免疫肿瘤学、血液疾病、自身免疫性疾病等领域的多样化在研管线,并取得优异的临床表现。
在11月5日,Intellia公布了另一款体内基因编辑疗法NTLA-2001治疗转甲状腺素蛋白(ATTR)淀粉样变性的最新1期试验中期数据。NTLA-2001旨在通过LNP,将靶向TTR基因的CRISPR基因编辑系统递送到人体内,特异性敲除肝细胞内的TTR基因,从而降低TTR蛋白的表达,减少致病蛋白的累积。
此次最新数据显示:12名转甲状腺素蛋白淀粉样变性患者进行单次静脉注射给药后28天,所有患者的血清TTR降低≥90%,且这些获益一直持续到接受输注治疗后4-6个月进行的最后一次访视。
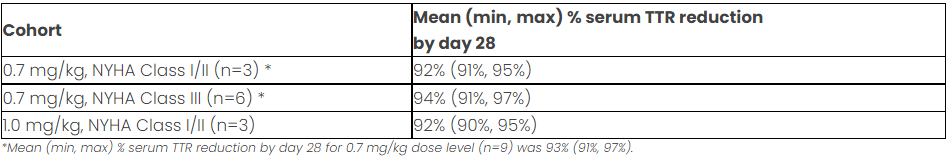
患者血清TTR水平临床数据(图片来源:参考资料2)
而在安全性方面,在两种剂量水平下,患者对该疗法耐受性良好。67%的患者报告了轻度或中度的不良事件,1例患者出现3级输液反应(0.7 mg/kg NYHA Ⅲ级组),但已得到缓解,未出现临床后遗症。根据研究方案,该组后续将从3名患者扩大到6名患者,以进一步评估该剂量水平下的安全性。
值得一提的是,Intellia与诺华合作开发,用于治疗镰状细胞病(SCD)的一款体外CRISPR/Cas9基因编辑造血干细胞疗法OTQ923也将在今年ASH年会上亮相。
根据摘要数据显示:截至2022年7月8日,接受OTQ923治疗的2名患者,中性粒细胞植入时间分别为26天和20天,且均未报告与治疗相关的不良事件。此外,1名受试者HbF水平在输注后6个月增加,并在数据截止时保持稳定(输注后9个月HbF为22.1%),另一名患者在输注后3个月HbF水平达到了15.9%。这些数据初步验证了OTQ923的安全性,为重度SCD患者提供了一种潜在的治疗选择。
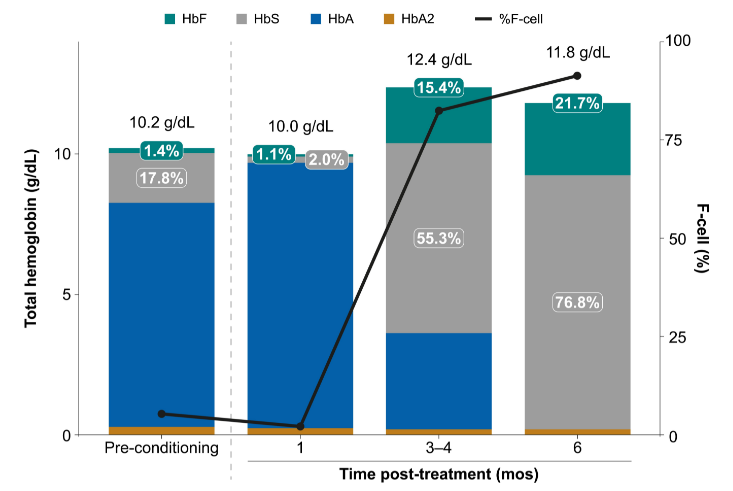
受试者HbF相关数据(图片来源:参考资料3)
结语
基因编辑技术在经历的多年的研发后,正在逐步从实验室迈进临床。而基于以上Intellia取得的两项优异成绩显示了基因编辑技术在治愈罕见遗传性疾病领域的潜力,这同时也为其他疾病的治疗开辟了一条新的途径。相信不久的将来基因编辑技术将在安全性和疗效上迎来突破,为患者带来更加安全的治疗选择。
参考资料:
1.https://www.biospace.com/article/releases/intellia-therapeutics-presents-new-interim-data-from-first-in-human-study-of-ntla-2002-for-the-treatment-of-hereditary-angioedema-hae-at-the-american-college-of-allergy-asthma-and-immunology-2022-annual-scientific-meeting/
2.https://www.biospace.com/article/releases/intellia-presents-updated-interim-data-from-the-cardiomyopathy-arm-of-ongoing-phase-1-study-of-ntla-2001-an-investigational-crispr-therapy-for-the-treatment-of-transthyretin-attr-amyloidosis-at-the-aha-scientific-sessions-2022/?keywords=CELL
3.https://ash.confex.com/ash/2022/webprogram/start.html