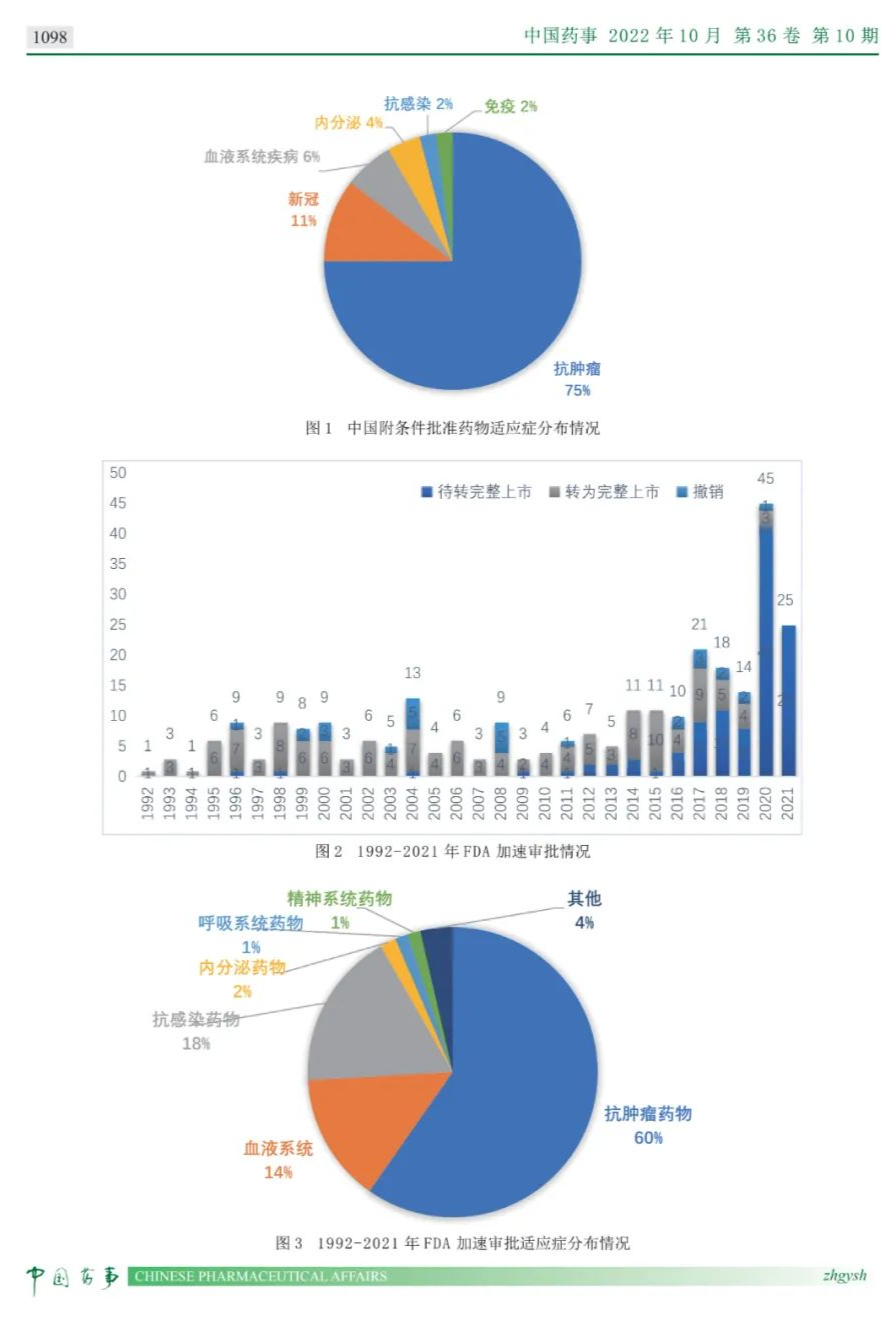
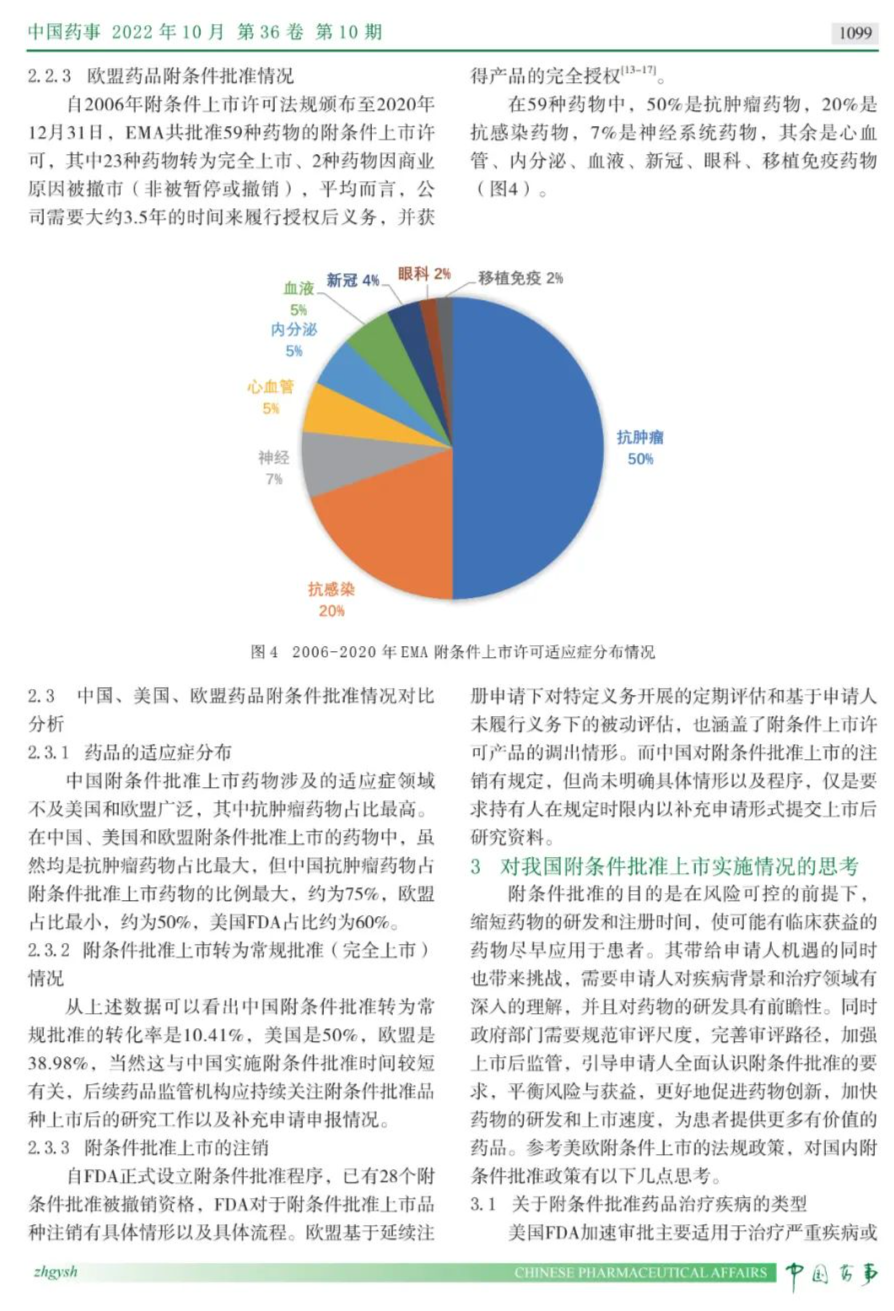
《中国药事》杂志2022 年 10 月 第 36 卷 第 10 期发布《我国药品附条件批准程序实施情况及相关思考》一文,文章通过梳理国家药品监督管理局(NMPA)药品附条件批准上市申请审评审批法规政策的实施情况,重点围绕当前法规中的准入条件、准入程序、上市后监管要求等进行综述。借鉴美国食品药品管理局(FDA)药品加速审批、欧洲药品管理局(EMA)药品附条件批准等相关经验,探讨我国药品附条件批准上市政策的发展方向。建议监管部门着重考虑对程序和技术要求的细化(如各类适应症附条件批准的评价标准)、制度之间的衔接(如紧急使用授权与附条件批准制度)以及加强药品附条件批准上市后的监管等方面问题,实现鼓励以临床价值为导向的药物创新,加快具有突出临床价值的临床急需药品上市。




本文来源:《中国药事》杂志 作者:袁利佳,陈小明,张宁