
图片来源:摄图网
渤健(Biogen)近日宣布,美国食品和药物管理局(FDA)已将tofersen新药申请(NDA)的审查期延长三个月。tofersen是一种反义寡核苷酸药物,用于治疗超氧化物歧化酶1(SOD1)突变的肌萎缩侧索硬化症(ALS)患者。更新后的《处方药申报者付费法案》(PDUFA)目标日期为2023年4月25日。
ALS是一种进行性神经退行性疾病,平均生存期为症状出现后3-5年。最常见的死亡原因是呼吸衰竭。SOD1-ALS是一种罕见的ALS基因型,在全球约168000名患者中占比为2%。目前,还没有针对ALS的基因靶向治疗方案。
FDA于2022年7月在加速审批程序下受理了tofersen NDA并给予优先审查。作为正在进行的审查的一部分,渤健提交了对FDA信息请求的回复,FDA认为这是对申请的重大修订,需要额外的审查时间。
渤健全球安全与监管科学主管、临时研发主管Priya Singhal表示:“我们致力于提供机构完成tofersen审查所需的任何细节。随着审查的继续,渤健将维持tofersen的早期获药计划(EAP)。”EAP能够保障患者在tofersen获得商业许可之前免费获得该药物。
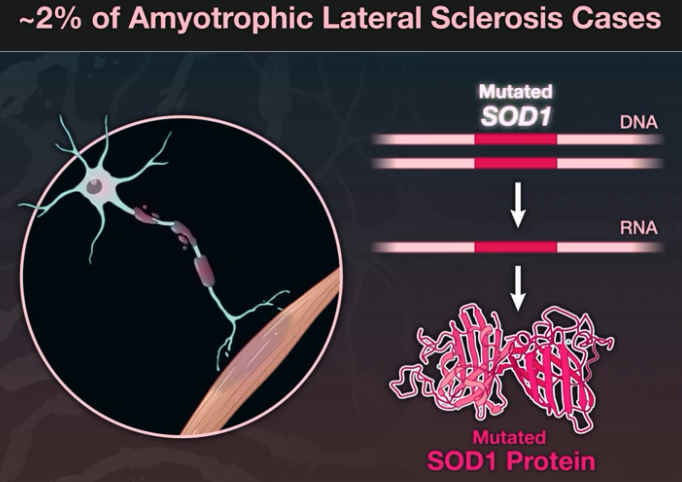
SOD1突变型ALS(图片来源于NEJM文献——PMID: 36129998)
肌萎缩侧索硬化症(ALS)是一种罕见的、进行性和致命的神经退行性疾病,会导致大脑和脊髓中负责控制自主肌肉运动的运动神经元丢失。ALS患者会经历肌肉无力和萎缩,由于逐渐失去移动、说话、进食和最终呼吸的能力,导致其失去独立性。ALS患者的平均预期寿命为症状出现后3-5年。
ALS涉及多个基因。基因检测有助于确定一个人的ALS是否与基因突变有关,即使在没有疾病家族史的个体中也是如此。目前,还没有针对ALS的基因靶向治疗方案。在全球约168000名ALS患者中,SOD1基因突变型ALS((SOD1-ALS)约占2%。SOD1-ALS患者的预期寿命差异很大,一些患者存活时间不足一年。
tofersen是一种反义药物,目前正在评估其对SOD1-ALS的潜在治疗作用。tofersen与SOD1 mRNA结合,允许其被RNase-H降解,从而减少SOD1蛋白的合成。渤健通过与Ionis Pharma的合作开发及许可协议,获得了tofersen的许可。
除了VALOR开放标签扩展(OLE)研究外,渤健也正在开展3期ATLAS研究,评估在携带SOD1基因突变、有疾病活动生物标志物证据的症状前患者中启动tofersen治疗是否能够延迟临床发病。
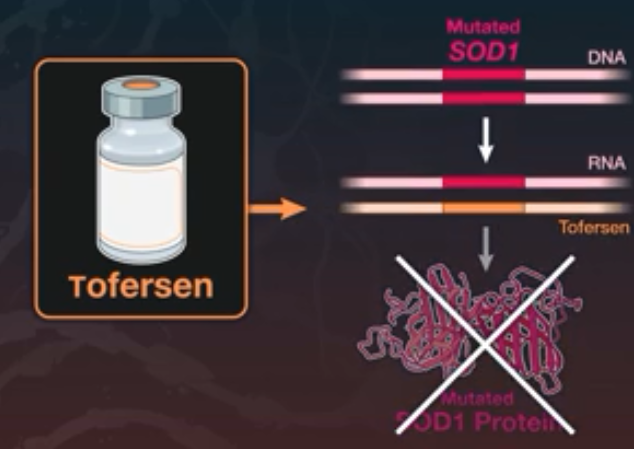
tofersen作用机制(图片来源于NEJM文献——PMID: 36129998)
VALOR是一项为期6个月的随机、双盲、安慰剂对照3期研究,旨在评估tofersen(100mg)在SOD1突变相关ALS成人患者中的疗效、安全性和耐受性、药效学和生物标志物效应。该研究中,共有108例患者被随机分配:tofersen 100mg组(n=72)、安慰剂组(n=36)。开放标签扩展(OLE)研究在已完成VALOR研究的患者开展。在108例患者中,有95例参加了正在进行的OLE研究。在分析时,所有患者都有机会进行至少12个月的随访,tofersen的中位暴露时间约为20个月(范围:1-34个月)。
VALOR研究的主要终点是从基线到第28周ALS功能评定量表修订版(ALSFRS-R)总分的变化。次要终点包括脑脊液(CSF)中SOD1蛋白总浓度、血浆神经丝轻链(NfL)、慢肺活量、16块肌肉的手持式测力计的变化。
VALOR和OLE研究的详细结果已于2022年9月发表于国际顶级医学期刊《新英格兰医学杂志》(NEJM),详见:Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS。
正如之前在2021年10月报告的那样,VALOR研究没有达到主要终点。然而,在多个次要终点和探索终点观察到疾病进展减少的趋势。合并的VALOR研究和OLE研究的12个月数据,其中临床分析调整了神经丝水平作为基线时疾病进展率的标志物,结果显示:早期开始使用toversen治疗,SOD1蛋白(靶标参与的标志物)和神经丝(神经变性的标志物)持续下降,减缓了临床功能、呼吸功能、力量、生活质量的下降。
在12个月数据中,VALOR和OLE研究中接受tofersen治疗的患者中,最常见的不良事件(AE)是程序性疼痛、头痛、手臂或腿部疼痛、跌倒和背痛。VALOR和OLE中大多数AE的严重程度为轻度至中度。在VALOR和OLE研究中接受tofersen治疗的患者中,6.7%报告了严重神经系统事件,包括脊髓炎、化学性或无菌性脑膜炎、神经根炎、颅内压升高和视神经乳头水肿。
原文出处:Biogen Announces FDA’s 3-Month Extension of Review Period for the New Drug Application for Tofersen