脊髓性肌萎缩症(SMA)是一种常染色体隐性遗传的神经肌肉疾病,由SMN1双等位基因缺失或致病性变异引起。SMN2是SMN1的同源基因,SMN2拷贝数与SMA发作和严重程度相关。具有三个SMN2拷贝的大部分患者表现为中度2型SMA。Onasemnogene abeparvovec是一种基因替代疗法,它使用一次性静脉输注的腺相关病毒9(AAV9)载体递送SMN cDNA。SPR1NT是onasemnogene abeparvovec用于治疗有SMA风险的症状前婴儿的第一项III期研究。本文汇总了15名具有三份SMN2拷贝数的症状前儿童接受治疗后的疗效和安全性数据[1]。
背景
具有三个SMN2拷贝的患者可能会发展为1、2或3型SMA,但54%的三个拷贝数患者在7个月至18个月之间表现为中度2型SMA,15%可发展为1型而31%发展为较温和的3型。 未经治疗的2型SMA儿童在13岁之前经历相对快速的神经肌肉衰退,随后在成年期逐渐衰弱。这些患者能够独坐,但很少可以站立,没有人能独立行走。随着年龄的增长,几乎所有2型SMA患者都会出现吞咽困难、关节挛缩、脊柱侧弯和限制性肺病,有些患者可能会失去独立坐姿的能力。3型SMA患者的症状发作较晚,并且出现的肌肉骨骼、呼吸和喂养问题越少,严重程度也越低。因为SMA临床框架内存在相当大的异质性,SMA2型和3型的观察性研究使用连续变量,例如运动表现、上肢力量和活动、肺功能和复合运动动作电位(CMAP)的测量。由于SMA早期治疗的成功,美国和其他几个国家已经对SMN1缺失进行了广泛的新生儿筛查,从而能够在症状出现之前识别出有SMA风险的儿童。这对治疗干预具有重要意义。Nusinersen (NURTURE)的II期研究结果表明了对有2型SMA风险的症状前儿童进行疾病修饰治疗的潜力。既往的研究证明了onasemnogene abeparvovec对具有三个SMN2拷贝的有症状SMA患者的安全性和有效性。然而,很少有干预研究针对具有3个SMN2拷贝且有SMA风险但尚未表现出疾病迹象的儿童。SPR1NT是onasemnogene abeparvovec用于治疗有1、2或3型SMA风险的症状前婴儿的第一项III期研究。共有29名SPR1NT参与者包括14名具有两份SMN2的儿童和15名具有三份SMN2的儿童。这里总结了15名具有三份SMN2的SPR1NT参与者的疗效和安全性数据。 结果 纳入标准和人口统计学资料 共有15名具有三个SMN2拷贝数的婴儿(女性,n=9;60%)被纳入SPR1NT。这些患者出生于35至41孕周(中位数39.0),体重中位数为3.4公斤(范围2.55-3.81)。大多数儿童(n=13;87%)是通过新生儿筛查诊断出来的。出生后诊断的14名婴儿在中位年龄8.0天(2-26)时得到了确诊的分子诊断。筛选时所有纳入的婴儿都表现出正常的神经肌肉功能,并且能够正常吞咽和呼吸。腓神经CMAP中位基线为4.10mV(2.7-7.0)。15名婴儿在中位年龄32天(9-43)时接受了onasemnogene abeparvovec输注,中位基线体重为4.1公斤(3.1-5.2)。所有儿童都完成了研究。 主要和次要运动终点
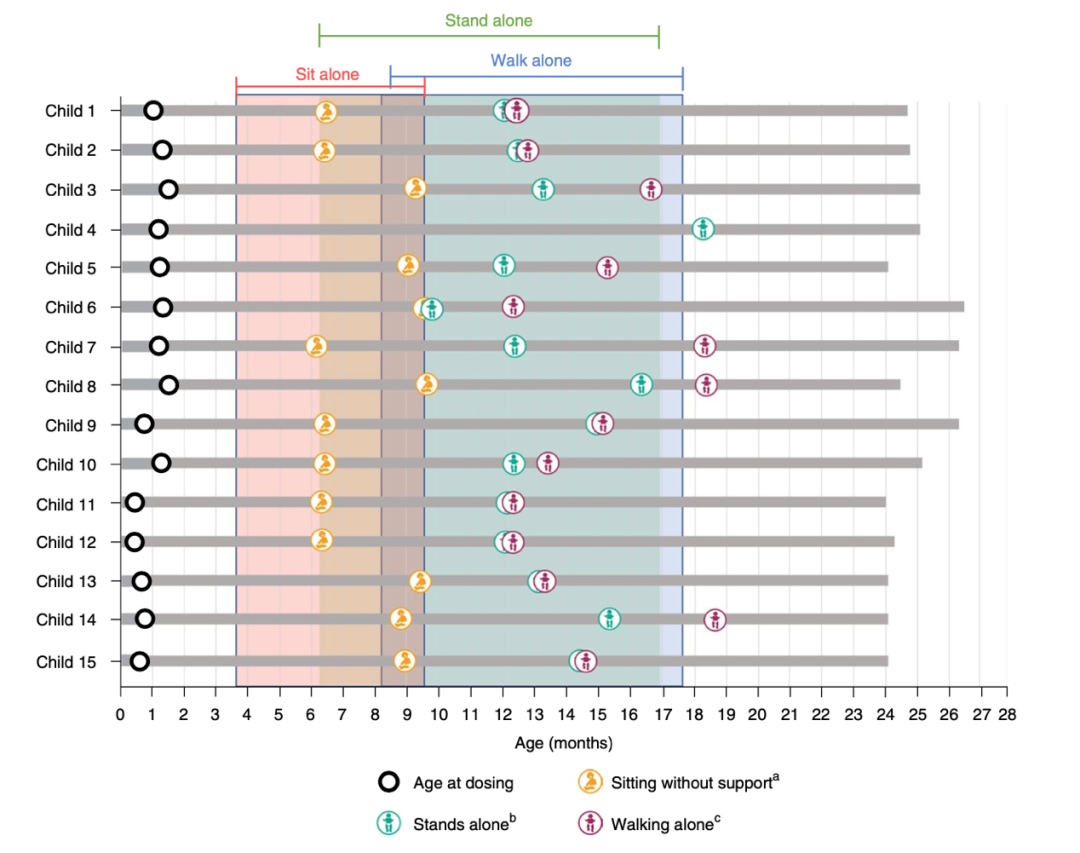
所有15名(100%)的儿童在24个月的任何访问中都达到了独立站立至少3秒的主要终点。在中位年龄377天(284-549)时实现了这一运动里程碑,15人中有14人(93%)在≤514天(第99个百分位数)的WHO正常发育窗口内实现了这一目标(图1)。相比之下,在PNCR自然史人群中,81名SMA患者中只有19名(24%)实现了独立站立(P<0.0001)。研究中的14名(93%)儿童在24个月的任何访视中独立行走至少5步,而PNCR人群中的仅有17名(21%)(P<0.0001)。独立行走的中位年龄为422.0天(362-563),11名(73%)儿童在≤534天的WHO正常发育窗口内达到了这一运动里程碑。在14个月时,所有人都在没有持续通气的情况下存活;10名(67%)在24个月内没有喂食支持的情况下保持体重(≥WHO第3个百分位数);并且没有人需要营养或呼吸支持。研究者认为没有严重的不良事件与治疗相关。使用贝利婴幼儿发育量表(BSID)对所有15名儿童进行了充分评估,接受评估的10名(100%)儿童的量表得分均≥4,粗大运动量表得分中位数为9(范围5-12),接近标准人群平均值。同时运动功能的改善与运动神经完整性得到保护的电生理学证据相一致。
安全性 为了减轻对AAV9的炎症反应,所有15名儿童在onasemnogene abeparvovec输注前1天开始口服泼尼松龙,并完成中位63天(49-321)的治疗。共报告了166起治疗中出现的不良事件(TEAE)。每个孩子都经历过至少一次TEAE,其中3名(20%)TEAE被报告为严重。15名儿童中有8名(53%)出现了研究者认为与研究治疗相关的TEAE,但没有一个是严重的。研究发起人(诺华基因治疗公司)确定了五种特殊类别的特别关注不良事件(AESI):肝毒性、血小板减少症、心脏毒性、血栓性微血管病(TMA)和提示背根神经节病的感觉异常。15名儿童中有4名(27%)发生了13次肝毒性AESIs,都是轻度或中度的,除了一个丙氨酸氨基转移酶升高的3级事件(正常上限的5倍以上)。所有肝毒性事件均已解决,包括使用增强泼尼松龙解决的3级事件。没有观察到黄疸或肝性脑病事件。2名(13%)发生了三起与血小板减少症相关的事件,这些事件是轻度或中度的,被认为与治疗无关。为了评估心脏毒性,最初测量了CK-MB,但在研究中期更改为更可靠的心脏组织标志物肌钙蛋白I。3名儿童报告了心肌酶升高的AE:1名CK-MB和肌钙蛋白I升高;一个人有孤立的CK-MB升高;一个人出现肌钙蛋白I的孤立性升高。所有事件都是轻度或中度的,被认为可能与治疗有关。在研究结束时,一名儿童的血清CK-MB仍然升高,另外两名儿童的心脏AESI消退而没有后遗症。研究期间未报告TMA事件。15名儿童中有1名(7%)AESI(反射消失),这可能与背根神经节病有关。 讨论 治疗没有表现出疾病症状的个体仍然存在争议。但在本研究中,有2型或3型SMA风险的儿童在6周龄之前,尚未出现症状时接受了一次onasemnogene abeparvovec治疗,表现出正常或接近正常的生长和神经肌肉发育模式。同时治疗安全性良好,没有发现新的或意外的安全问题。本文还纵向比较了SPR1NT系列研究以及nusinersen治疗有2/3个SMN2拷贝数的症状前SMA的研究。虽然这些试验设计的显着差异阻碍了它们之间的直接比较,但仍旧可以看出临床症状很少或没有临床症状时接受治疗似乎比在疾病临床发作后接受治疗的儿童实现了更先进的发育里程碑,强调了治疗时机(即在临床症状出现之前)作为结果的潜在重要决定因素的重要性。本研究的局限性在于纳入标准过于严格,导致纳入样本量过少。这项研究结果强调了通过新生儿筛查早期识别有SMA风险儿童的紧迫性,以及及时治疗以预防死亡和残疾的必要性。