Lesch-Nyhan综合征(LNS)是一种由于次黄嘌呤-鸟嘌呤-磷酸核糖基转移酶缺陷造成嘌呤核苷酸补救合成障碍的罕见遗传代谢病。因1964年由两位美国医生M.Lesch和W. L.Nyhan首次报道得而得名[1]。LNS患者通常会出现自毁行为,因此也被称为自毁容貌综合征。LNS综合患病率约为1:380,000[2]。
Lesch-Nyhan综合征是一种类似于脑瘫的运动功能障碍疾病。以神经功能障碍,认知和行为障碍以及尿酸过度产生为特征[2]。
1.神经功能障碍。LNS患者通常具有正常的产前和围产期过程。最常见的表现是在出生后第一年内出现发育迟缓,通常在出生三到六个月的时候就会出现肌张力低下和运动技能延迟。在出生后最初几年中,患者会出现运动功能障碍,其特征是重度肌张力障碍,其它症状还有舞蹈症、角弓反张等。另外患者还会出现锥体受累的迹象,包括痉挛,反射亢进和伸肌足底反射等。神经影像学提示动脉粥样硬化性脑瘫。最初,许多受累儿童可能会被诊断为脑瘫。患者运动障碍通常较严重,以至于几乎所有患有典型LNS的儿童都终身不能行走,而只能依赖轮椅活动。
2.认知和行为障碍。大多数患者认知能力受损(但其受损程度可能因行为障碍,运动障碍和注意问题而难以评估)。几乎所有患者最终都会出现持续的自残(自毁)行为,这是该疾病的标志性特征。自残最常涉及手指,手,嘴唇和脸颊的咬伤。其他行为包括用头部或四肢撞击硬物。有些患者在出生头一年内就会表现出自残行为;大多数患者会在两到三岁之间出现;有些则出现较晚。其他强迫行为可能包括攻击性,呕吐,随地吐痰和秽语症等。
3.尿酸过量。患者出生时即伴有尿酸过量,但常规临床实验室测试方法可能无法识别。血清尿酸浓度通常是正常的,因为过量的嘌呤会完全排入尿液。尿酸过量产生可能导致尿酸晶体,尿酸钠或结石在肾脏、输尿管或膀胱中沉积。结石可能导致血尿,并增加尿路感染的风险。结石可能是这种疾病的早期特征之一,但也可能数月甚至数年内都未被发现。另外尿酸晶体也可能在关节中沉积,从而导致在患病晚期出现痛风样关节炎,伴有肿胀和压痛。
LNS其它临床症状还可能包括生长和青春期延迟、终末期肾病(ESRD)、睾丸萎缩(男性)以及B12缺乏导致的巨幼细胞性贫血等。
Lesch-Nyhan综合征致病基因为HPRT1(目前已知唯一),位于Xq26.2q26.3,基因大小约44kb,包含9个外显子(常用转录版本NM_000194)。HPRT1基因编码的次黄嘌呤-鸟嘌呤-磷酸核糖转移酶(HGPRT)参与嘌呤补救合成(两种嘌呤合成途径之一)。细胞内代谢产生的大约90%的游离嘌呤可被回收,两种酶HGPRT和腺嘌呤磷酸核糖转移酶(APRT)在嘌呤补救途径中发挥关键作用,HGPRT回收次黄嘌呤和鸟嘌呤,APRT回收腺嘌呤[3]。HGPRT可以在磷酸核糖焦磷酸盐存在下,对次黄嘌呤转化为肌苷单磷酸(肌苷酸,IMP)和鸟嘌呤转化为鸟嘌呤单磷酸(鸟苷酸,GMP)进行催化,从而能够从DNA和RNA中回收嘌呤(嘌呤是DNA及RNA的组成部分,回收嘌呤可以确保细胞有足够的原料合成DNA和RNA)。HPRT1基因变异会导致HGPRT酶活性降低甚至完全丧失,使得次黄嘌呤和鸟嘌呤不能转化为嘌呤而过度累积,从而最终导致尿酸(嘌呤废物)的过度产生。由于尿酸在体液中不易溶解,因此其累积会导致泌尿系统(肾结石)和关节(痛风性关节炎)沉积。LNS相关神经行为异常的发生机制目前尚不完全清楚,但被认为可能与基底节功能障碍有关[4]。
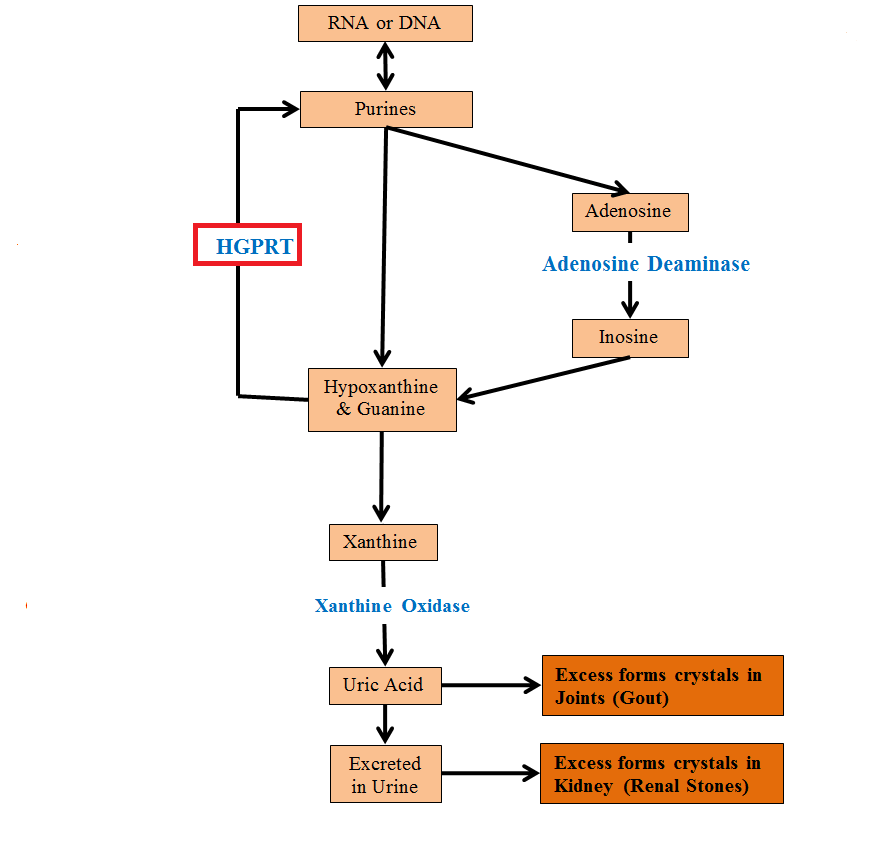
图1 HGPRT相关嘌呤合成通路
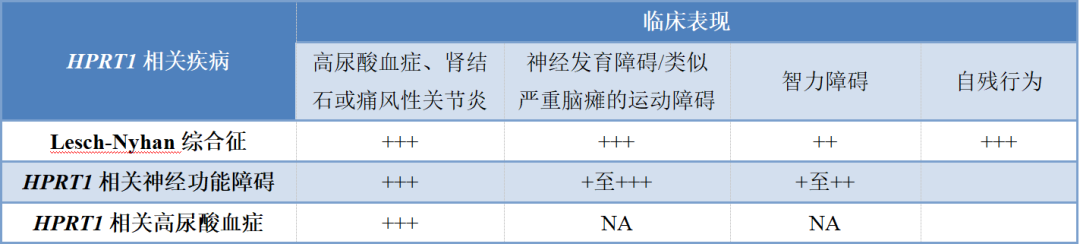
HPRT1基因导致的疾病依据临床表现和严重程度可以分为Lesch-Nyhan综合征(严重型)、HPRT1相关神经功能障碍(中间型)和HPRT1相关高尿酸血症(Kelley-Seegmiller综合征)(轻型)[2]。其常见临床及表现程度见表1。
表1 HPRT1基因相关疾病临床分类
Lesch-Nyhan综合征的临床标志是尿酸水平升高,对于临床怀疑LNS的患者通常最初的筛查是检查血液或尿液中的尿酸水平,如果尿酸与肌酐之比大于2.0,表明尿酸过度生产(高尿酸血症,通常血清尿酸浓度> 8 mg/dL),另外24小时尿酸排泄量>20 mg/kg也是LNS的特征之一,这些指标可以增加LNS的可能性,但都不是诊断性的,需要通过进一步地酶活检测或基因检测完成诊断。
1、酶活检测。即评估HGPRT酶活性。如果组织细胞(血液、皮肤细胞等)中这种酶的活性低于正常细胞水平的2%(也有报道为1.5%),则可以诊断为Lesch-Nyhan综合征。另外HPRT1相关神经功能障碍患者酶活性一般为正常水平的2%-8%,而HPRT1相关高尿酸血症患者酶活性一般为正常水平的10%以上。这也是对HPRT1相关疾病进行分型的一种量化指标。
2、基因检测。即检测HPRT1基因是否存在致病变异,从而能够从分子层面明确病因和来源,为遗传咨询、优生优育等提供遗传学证据。目前人类基因变异数据库(HGMDpro)收录的HPRT1变异已有443种,其中SNV/InDel 366种(83%),大片段缺失/重复77种(17%),与GeneReview记录的致病类型比例[2](表2)基本一致。金准 2w、金准-全外和代谢/神经系统panel等均可对现有报道的变异类型进行全面检测。
表2 HPRT1基因变异类型

目前Lesch-Nyhan综合征没有单一有效的治疗方法或药物,主要是对症治疗。痛风可以用别嘌呤醇治疗,以控制过量的尿酸。肾结石则可以通过碎石治疗。LNS的神经症状没有标准治疗方法,有些可以通过卡比多巴/左旋多巴、地西泮、苯巴比妥或氟哌啶醇缓解[5]。
为了降低肾病、肾结石和痛风性关节炎的风险,必须控制尿酸的过量产生。别嘌呤醇用于氧嘌呤转化为尿酸,并防止随后发生的关节炎性痛风、肾结石和肾病。别嘌呤醇为口服方式,其典型剂量为3-20毫克/千克/天。然后调整剂量,使尿酸水平降至正常范围(<3 mg/dL)。大多数患者一生都可以用别嘌呤醇治疗。
对于锥体外系运动障碍,目前没有药物能有效地控制。然而,使用巴氯芬或苯二氮卓类药物可以减轻痉挛的发作。
对于疾病相关神经行为障碍(自残等),可以通过三个要素进行管理和控制。其中最重要的是通过身体约束进行预防,比如所有锋利和危险的物体必须放在够不着的地方,有些会咬伤自己的患儿则必须拔掉牙齿等;第二个要素是行为疗法,大多数是通过受过行为治疗培训的专业人员来完成,其目标是把注意力集中在好的行为上而忽略坏的行为;第三个要素是药物,包括加巴喷丁、卡马西平、地西泮等在内的药物可以减少自残行为的发生频率,但很少能完全消除。另有文献[6]报道了一项口服S-腺苷甲硫氨酸(SAMe)(一种已批准的治疗抑郁症的药物)治疗LNS相关神经行为障碍的实验,这种药物是一种核苷酸前体,提供易于吸收的嘌呤,可通过血脑屏障运输,一名患有LNS的男性患者在接受SAMe治疗后自残行为明显减少、舒适度得到提升。
受检者:男,18岁
2岁+诊断为脑瘫,智力低下,无法独立坐,不会说话,有自残倾向。
检测项目:金准 dyn2w
检测结果:
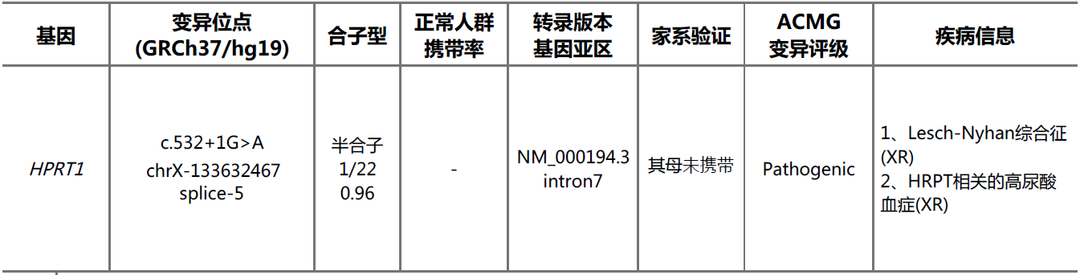
受检者chrX:133632467存在c.532+1G>A的半合子变异
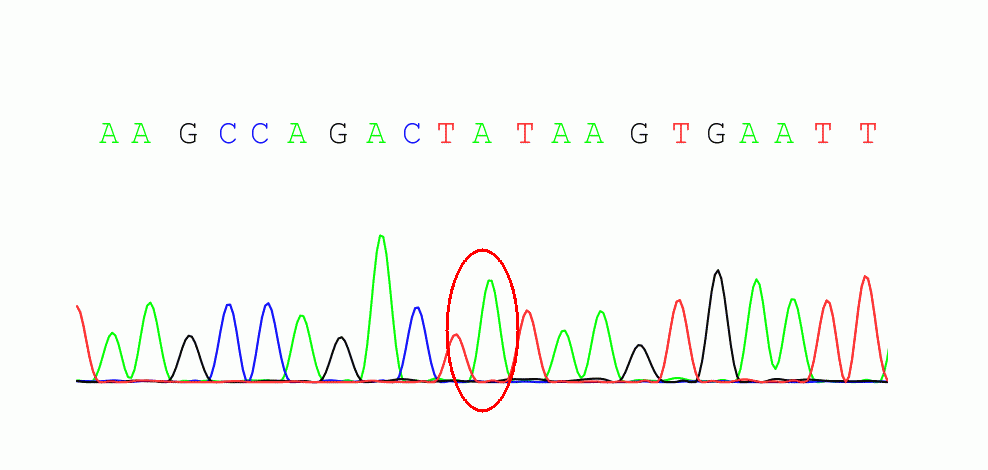
受检者之母chrX:133632467未发现变异
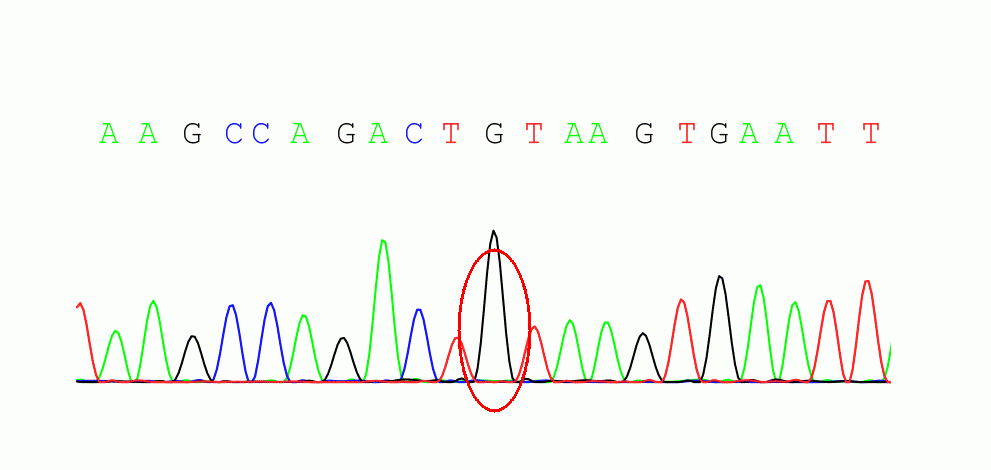
报告解读:HPRT1基因相关Lesch-Nyhan综合征为X连锁隐性遗传,受检者在此基因发现一处半合子变异c.532+1G>A,此变异在HGMDpro数据库已有报道(PubMed_ID:11018746),家系验证显示其母此位点未发现变异。根据ACMG指南,该变异评级为Pathogenic(PVS1+PM2_Supporting+PM6)。HPRT1相关LNS可以解释患者的临床表型,很可能是受检者的致病原因。
[1]. M. Lesch, W. L. Nyhan. Am J Med. 1964 Apr;36:561-70. PMID: 14142409 [2].https://www.ncbi.nlm.nih.gov/books/NBK1149/ [3].Fu R. Mol Genet Metab. 2014 August ; 112(4): 280–285. PMID: 24930028 [4]. J E Visser. Brain Res Brain Res Rev. 2000 Apr;32(2-3):449-75. PMID: 10760551 [5]. Uros Hladnik. Arch. Neurol. 65 (9): 1240–3. September 2008. PMID 18779430 [6]. Norris Glick . J Inherit Metab Dis. 2006 Oct;29(5):687. PMID: 16906475