近年来,阵发性夜间血红蛋白尿(PNH)在了解其病理生理学、现代诊断方法、治疗优化方法和新治疗药物的动态开发方面取得了新的进展,这篇综述强调了在选择有缺陷的克隆时,PNH干细胞对细胞凋亡的敏感性降低的重要性大于先前公认的重要性。

阵发性夜间血红蛋白尿的治疗
治疗PNH有两种有效的策略:使用补体C5抑制剂和同种异体HSCT。治疗方法的选择取决于PNH的表现。补体成分C5的抑制剂(C5抑制剂)是目前对经典溶血形式的PNH的治疗标准。在伴有BMF的PNH中,治疗应主要集中于骨髓疾病-再生障碍性贫血(PNH/AA)或骨髓增生异常综合征(PNH/MDS)。
Eculizumab是第一个使C5补体成分失活的单克隆抗体,于2007年被批准用于PNH的治疗。2018年,另一种抑制剂Ravulizumab获得批准。这两种抑制剂都能阻止末端MAC的形成,从而阻止血细胞的溶解。C5抑制剂改变了疾病的自然病程。自从Eculizumab被引入诊所以来,预期寿命有所增加,接受治疗的患者的5年生存率为96.5%。
Eculizumab可预防慢性PNH溶血并发症,如肾脏损害、肺动脉高压和血栓栓塞并发症,这些并发症对病程和死亡率的影响最大。使用Eculizumab治疗是安全且耐受性良好的。对于肾功能不全或损害的患者,它改善了慢性肾病(CKD)初期的个体以及3期或4期CKD患者。研究证实了Eculizumab治疗PNH患者生活质量的有益影响,也显示了生活质量试验的成分与血红蛋白和LDH浓度之间的关系。
对于LDH浓度增加且存在以下症状或条件的严重溶血患者,应开始Eculizumab治疗,如:
1.有心血管症状的患者出现血红蛋白水平低于7g/dl或低于10g/dl的贫血;
2.Subab PNH相关血栓形成;
3.溶血并发症:肾功能衰竭加重,肺动脉高压,表现为呼吸困难;
4.腹痛和/或吞咽困难和/或勃起功能障碍;
5.怀孕,特别是以前有过流产或其他妊娠并发症。
要求输血或PNH克隆的大小不适合治疗C5抑制剂,没有或有轻度溶血症状、全血细胞计数正常和PNH缺陷粒细胞的小克隆(<30%)的患者均不需要使用C5抑制剂治疗。AA或MDS患者和伴随的高比例的PNH细胞也可能受益于C5抑制剂的使用。
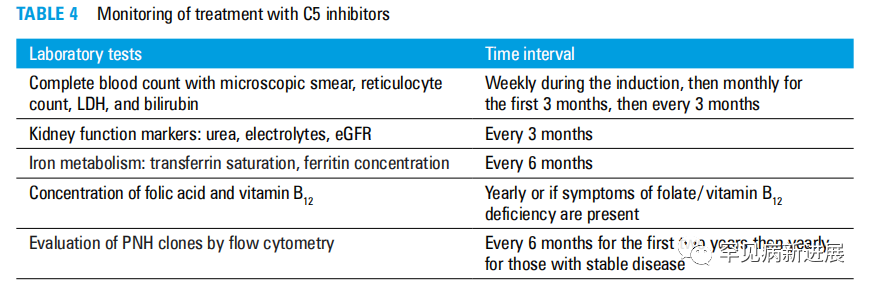
图4 对C5抑制剂治疗的监测
超过90%的患者对Eculizumab有反应,但只有约10%的患者达到完全缓解,血红蛋白水平正常化;35%-40%的患者开始独立于红细胞输血,但仍有轻度贫血;另外30%的患者患有中度贫血,需要红细胞输血。
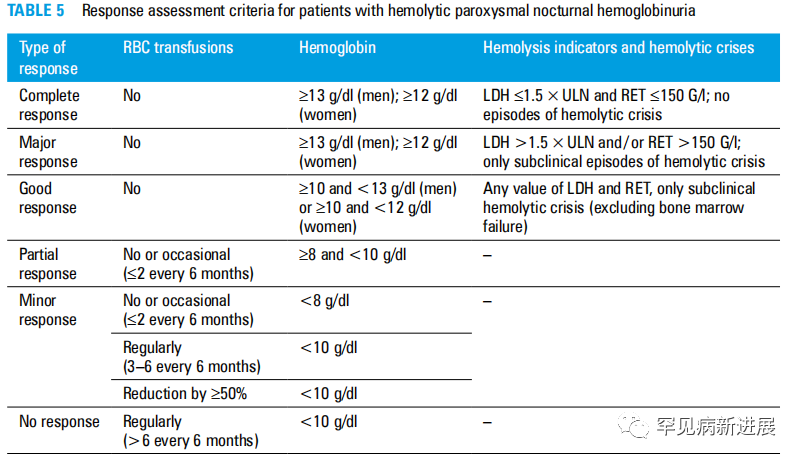
图5 溶血性阵发性夜间血红蛋白尿患者的反应评估标准
反应的质量取决于PNH克隆的大小、BMF的程度、伴随的炎症过程和遗传因素。在使用Eculizumab治疗的过程中,预期的结果是减少溶血和疲劳,改善生活质量,并在1至3周后缓解呼吸困难;2至6个月后输血次数减少,血红蛋白水平稳定;6个月后,生活质量稳定改善,疲劳减轻,LDH活性正常化,血红蛋白浓度稳定,不依赖于输血红细胞。在36个月至10年内,预计可维持低溶血率和血栓事件的持续改善。
对Eculizumab治疗的不完全反应有3个主要原因。首先,红细胞生成素骨髓反应不足可能是由于伴随的BMF,但在这种情况下,也应考虑叶酸、维生素B和铁的缺乏。第二,由于C5抑制不佳而导致的残留血管内溶血可能导致残留贫血,但可能通过增加Eculizumab的剂量来控制。第三,持续的血管外溶血可能与C3成分的激活有关,这是由于C5抑制剂对CD55依赖的C3转化酶的激活没有影响。另外,对Eculizumab治疗无反应的一个罕见原因是补体1受体基因的存在,补体1受体增强了C3转化酶的分解,当C5被抑制时,它们在红细胞表面的密度调节C3片段与gpi阴性红细胞的结合。
Ravulizumab与Eculizumab只在4个氨基酸中有所不同,并与Eculizumab具有相同的益处,具有相似的安全性和耐受性。Ravulizumab的半衰期是Eculizumab的4倍,每8周静脉注射一次。在比较Ravulizumab和Eculizumab的III期研究中,两种药物在稳定血红蛋白水平、降低/正常化LDH水平、确保输血独立性和改善生活质量方面显示出相同的疗效。
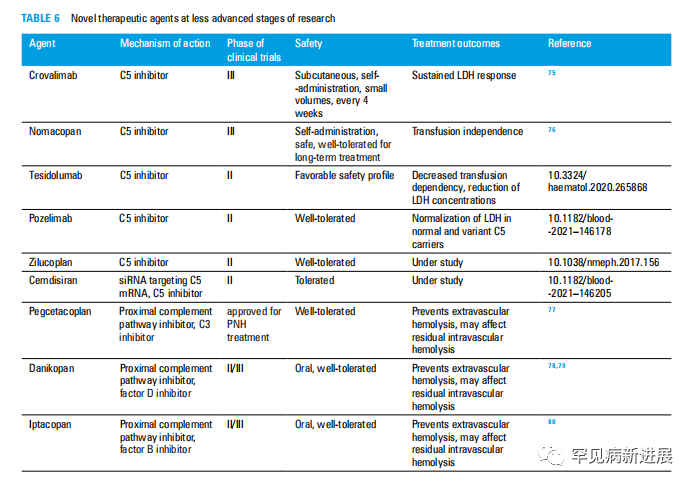
图6 处于非晚期研究阶段的新型治疗药物
Crovalimab是一种长效单克隆抗体,可由患者皮下自行给药。在I/II期研究中,对于LDH持续反应低于1.5 ULN的患者,最佳给药频率为每4周一次。III期试验正在进行中,针对未治疗和Eculizumab暴露的患者。
在III期或较低的研究阶段:Tesidolumab (LFG316)、Pozelimab、Zilucoplan和Cemdisiran。这些数据表明,nomacopan对患者自我给药的长期PNH治疗是安全且耐受性良好的,并在输血独立性方面为患者提供了显著的治疗益处。
值得注意的是近端补体途径的抑制剂,它们主要是防止依赖于补体成分C3的激活的血管外溶血,但也可能影响残留的血管内溶血。针对补体途径的3种不同成分的药物正在开发中:补体C3、补体因子D和补体因子B。
2021年批准用于PNH治疗的第一个C3补体抑制剂是聚乙二醇计划,这是一种聚乙二醇化抑制素。第一个口服D因子抑制剂是Danikopan,一种替代近端补体途径的口服抑制剂,第一个口服B因子补体抑制剂是Iptakopan。这些药物在II期和III期研究中,联合Eculizumab或单药治疗血管内和血管外溶血均显示出显著疗效。
与补体抑制剂使用相关的主要风险是感染。Eculizumab增加了危及生命的奈瑟菌感染的风险。风险估计为每年0.5%或10年后为5%。因此,所有接受Eculizumab治疗的患者都应在接受第一剂Eculizumab治疗前至少2周接种针对ACYW135血清型和血清组B的四价疫苗,并且服用厄库利珠单抗的患者都应接受青霉素预防。根据目前的指南,通常建议每2.5-3年复查一次。
由于PNH的血管内溶血,铁在尿液中丢失,骨髓中红细胞生成的增加导致红细胞产生所必需的因素的消耗增加;因此,PNH患者通常需要补充铁、叶酸和维生素b12。PNH患者也可能需要红细胞输血。输血暂时提高血红蛋白水平,因为输血的红细胞含有抵抗补体裂解的CD59和CD55蛋白。应使用白细胞耗尽的产品,并建议对计划进行同种异体HSCT的患者使用辐照血液产品。
糖皮质激素不影响PNH中的补体依赖性溶血,但可用于治疗0.3-剂量为0.6mg/kg/天的泼尼松的血管外溶血。约70%的成年患者的血红蛋白水平升高,但长期治疗与并发症相关。
一些促红细胞生成能力减少的患者可能受益于服用高剂量的促红细胞生成素或达贝波伊素。重组G-脑脊液可用于感染期间的粒细胞减少症患者,特别是在骨髓发育不全的PNH患者中。
抗凝治疗
大约50%的PNH患者发生血栓栓塞并发症,30%的患者因此死亡。血栓形成的风险随着PNH克隆的大小的增加而增加。使用Eculizumab治疗可显著降低血栓形成事件的发生率。对于已经服用Eculizumab的患者,华法林或醋硝香豆醇的初级抗凝预防可能增加出血并发症的风险。对于未使用Eculizumab治疗的患者,在存在大型PNH克隆且无该类治疗禁忌症的情况下,应考虑使用华法林或醋硝香豆醇进行预防性抗凝。在围手术期和固定期,以及从妊娠的前三个月到产褥期结束,应使用低分子肝素预防。有急性血栓事件的患者应接受抗凝治疗,如有临床显著的血栓形成,应长期继续治疗。
造血干细胞的移植
HSCT是唯一一种能提供治疗PNH的机会的治疗方法。异体移植可以消除自体PNH克隆,但与显著的发病率和死亡率相关。此外,并不是所有的患者都有与HLA兼容的供体,而且有三分之一的患者会发生急性和慢性移植物抗宿主病。
研究表明在Eculizumab治疗的时代,同种异体-HSCT并不是大多数患者的治疗选择,仅限于严重BMF患者和那些对Eculizumab治疗反应不佳或无法获得它的患者。在C5抑制剂的时代,同种异体的HSCT治疗严重血栓栓塞并发症的疗效,由于高毒性和高死亡率,似乎存在争议。PNH/AA或PNH/MDS患者从同种异体-HSCT中获益更多。