随着药理学创新的迅速发展,具有高度特异性的补体抑制剂,尤其是依库珠单抗代表的C5抑制剂,选择性阻断抗AChR抗体,治疗全身型重症肌无力(MG)实现精准医学治疗。本篇综述在MG病理生理学已有认知的基础上,汇总依库珠单抗临床应用和管理上的一些要点事项,展开叙及多种补体疗法、靶向治疗等。期待未来对各亚型MG有更丰富的个体化治疗方案。
MG补体激活途径
重症肌无力(MG)是一种由乙酰胆碱受体抗体(AChR Ab)介导、细胞免疫依赖、补体参与、主要累及神经肌肉接头(NMJ)突触后膜乙酰胆碱受体的获得性自身免疫性疾病。补体在MG的发病过程中起着重要作用,补体激活损伤NMJ的突触后膜,减少膜表面积,减少AChRs和电压门控钠离子通道(VGSCs)的数量。当补体系统的反应是针对病原体的时候,病原体可随后被消除。然而,在自身免疫性疾病中,自身抗原的持续存在,形成了一种病态的慢性刺激[1]。
目前对于补体系统的研究进入到一个新阶段,成为MG研究的热点。补体的调节机制相当精细平衡,基于抑制补体系统的探索为补体靶向免疫调节疗法奠定基础,比 大多MG传统治疗更安全、有效。如图1所示的相关MG补体激活路径,不仅在动物试验模型中得到证明,人源化单抗依库珠单抗等药物的临床实践相当于对补体系统的再度验证[2]。
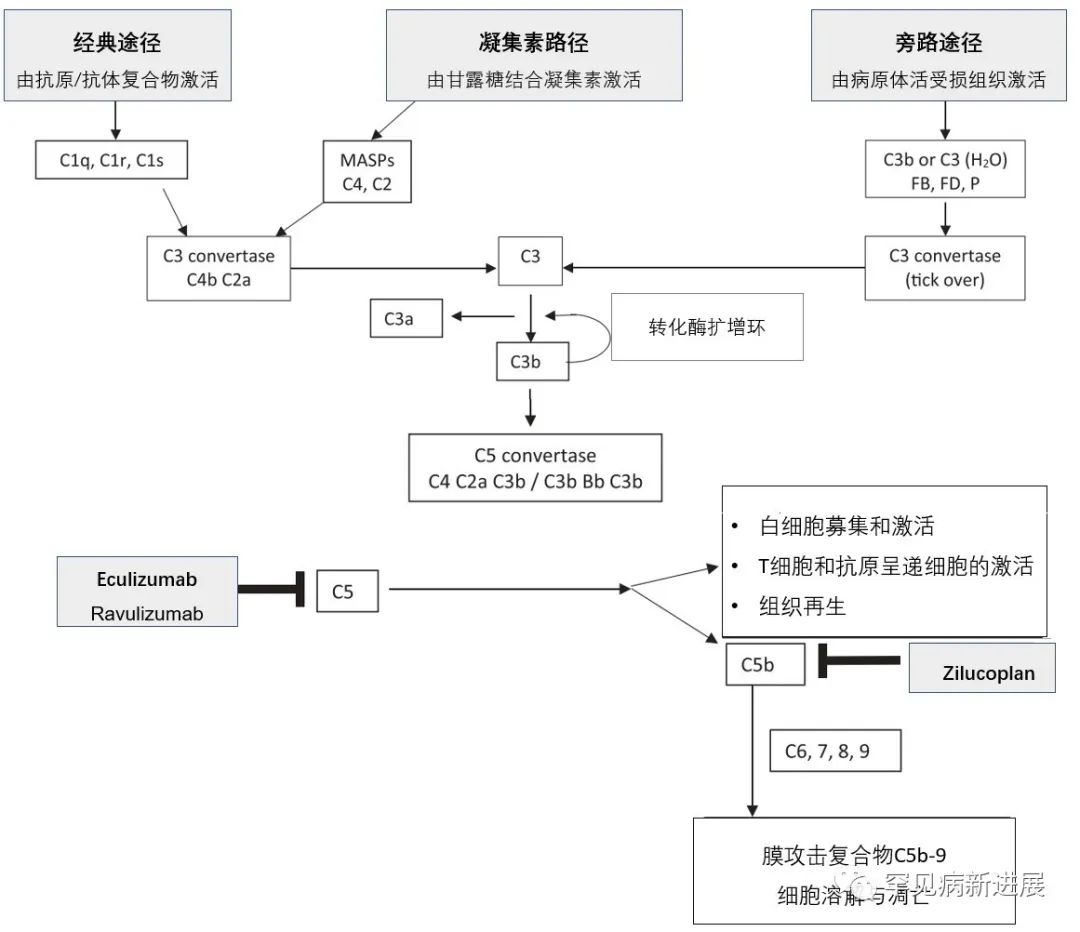
图1. 补体激活路径及其在MG的作用
依库珠单抗的当下与未来
依库珠单抗治疗MG的真实世界研究证实,其疗效与安全性和临床试验一致。美国密苏里大学的这项研究回顾了2016-2019年间依库珠单抗治疗的15例难治性AChR+ gMG患者,MG每日生活活动量表(MG-ADL)得分均降低,MG恶化次数减少(图2),单次呼吸计数增加;经12个月的治疗所有患者的重症肌无力定量评分表(QMG)达到“无”或“轻度”,且降低了对激素等多药物联用的需求 [3]。安全性上仅报告了10次轻度不良事件。同是对难治性AChR+ gMG疗效的研究,日本一项依库珠单抗上市后的期中分析显示,2017-2019年间的40例患者,MG-ADL、QMG的平均分值下降,静脉注射免疫球蛋白(IVIg)的需求下降,仅报告了16次AE。
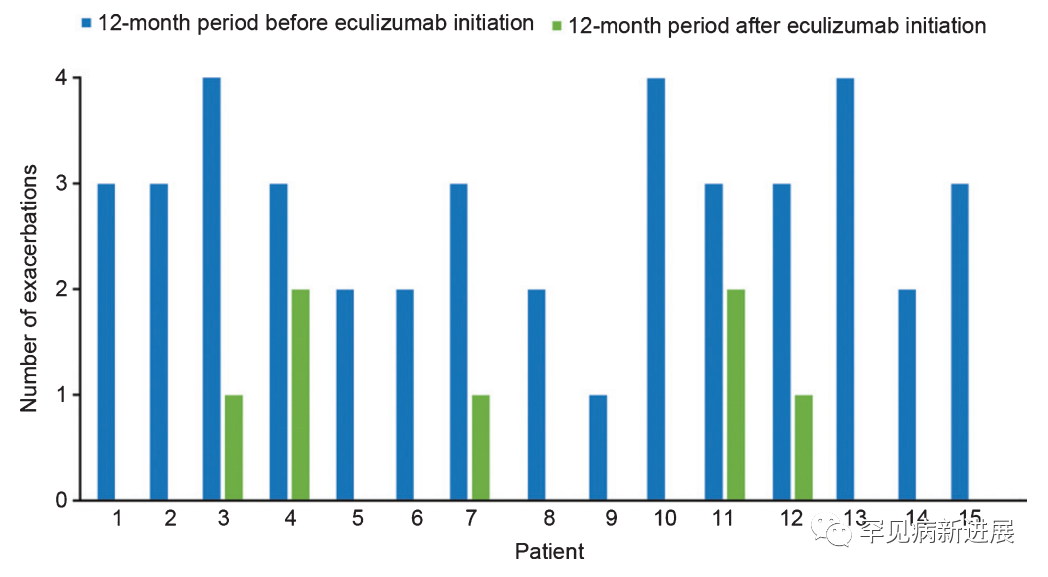
图2. 依库珠单抗治疗15例难治性AChR+ gMG患者
依库珠单抗被美国神经病学会发布的《重症肌无力管理国际共识指南:2020更新》推荐治疗重症、难治性AChR+ gMG,其获批被视为MG领域的重大进展,但仍有很多层面亟待继续推进,以挖掘药物的最大效益。 对依库珠单抗治疗无反应患者的特征研究,探索用血清学指标、遗传、表观遗传信息预测治疗反应性。 目前依库珠单抗治疗难治性AChR+ gMG采用的是单一剂量方案,下一步需细化多剂量规格、治疗时机、治疗时长方面的规范。根据一些专家的说法,在成功治疗6个月并确认最大反应性后,可延长依库珠单抗的输注间隔。 关于如何减停依库珠单抗的使用仍缺少完善的数据支持。在临床试验中,依库珠单抗治疗3个月后大部分症状即显示改善,对后续治疗不再有显著提升的情况下,可能需考虑药物的减停措施,如何减停更利于稳固已获得的治疗益处,尚待理清。 依库珠单抗对MG各亚型的适用性仍待补充研究。已有个别研究或病例报道,依库珠单抗对血清学阴性MG、胸腺瘤MG的治疗益处,这被视为药物扩大应用的前景。 还需关注依库珠单抗对MG疾病不同进展阶段的应用。有病例曾报道其在MG恶化、肌无力危象上的救治作用。 另一方面,接受依库珠单抗治疗的患者感染奈瑟菌的风险更高,脑膜炎球菌发病率提高1000-2000倍。因此,开始依库珠单抗治疗前,患者须接受两种类型的脑膜炎球菌疫苗接种。神经科医生应该警惕,接种疫苗虽然降低了风险,但并不等于消除风险,应按程序告知患者脑膜炎球菌性脑膜炎的风险和症状,并对患者保持随访监测。 COVID-19大流行期间,建议接受免疫抑制治疗的MG患者接种新冠疫苗。有关COVID-19疫苗接种前后对MG持续治疗的影响仍缺少充分评估,但已有报道多证实两者间的相互干扰不明显。对肌无力危象和严重延髓症状的患者,应推迟疫苗接种。因为新冠病毒感染对应C5补体水平的增加,依库珠单抗能抑制C5补体,甚至有学者在研究依库珠单抗对新冠病毒感染的疗效。
更多MG创新药物与潜在疗法
雷夫利珠单抗是目前唯一获美国FDA批准用于治疗gMG的长效C5补体抑制剂,相当于依库珠单抗的升级版,通过加入了两个结构变化,延长其末端消除半衰期、增强药效。药效作用时间得以延长4倍之多,一年只用注射几次,极大地改善了患者的生活。
Zilucoplan 是一种分子量较小的大环肽,可高亲和力、特异性与C5结合,双重机制阻止 MAC 的下游组装。最新公布的三期临床试验结果显示,对gMG患者疗效、安全耐受性良好。在其安慰剂对照RAISE试验中,采用的是皮下给药0.3mg/kg方案。
如图3所示,基于MG病理机制的潜在疗法还有很多处于探索之中,这些药物大多已经被开发出来并获批用于其它免疫性疾病,为MG的治疗提供了更多可能。
抗IFN疗法(图3A)
I型干扰素(IFN-I)在胸腺的过度表达,特别是IFN-β,被认为有调节胸腺作用,因此抗IFN-I类单抗是一种潜在疗法,如罗丽珠单抗(rontalizumab)、西法木单抗(sifalimumab)。miRNAs的最新研究揭示,通过结合和降解信使RNA调节转录后基因表达,可抑制翻译和蛋白质表达。在实验性自身免疫性MG动物模型中发现,MiR-29参与调节IFN-I信号,增加IFN-β表达。
趋化因子拮抗剂(图3A)
趋化因子CXCL13在雄腺上皮细胞的高表达有利于细胞募集,靶向CXCL13或其它因子是MG的潜在疗法。
基于T细胞共刺激途径的治疗(图3B)
T细胞受体(TCR)与主要组织相容性复合体(MHC)结合的表位之间的相互作用是适应性人类免疫反应中最重要的过程之一。在CR和肽-MHC初始作用后,带来共刺激增强、抑制T细胞活化。通过调节共刺激路径上的因子,达到下游信号干预的作用。如靶向CD80/86的阿巴西普(Abatacept)、靶向CD40的iscalimab、可诱导共刺激因子(ICOS)的抗体、靶向CD25的daclizumab、JAK抑制剂Tofacitinib,及CAT-T疗法等。
调控T细胞因子(图3C)
通过上调Th17 和Tfh及关联的细胞因子,如IL-6受体拮抗剂托珠单抗(tocilizumab)、IL17受体拮抗剂布罗利尤单抗(Brodalumab),对治疗MG有益。使用维生素D、西罗莫司(Rapamycin)、粒细胞-巨噬细胞集落刺激因子则可干预Tregs。
靶向B细胞(图3C)
利妥昔单抗、奥瑞珠单抗(ocrelizumab)、奥法妥木单抗(ofatumumab)均是靶向CD20的B细胞耗竭药物。靶向CD19的伊奈利珠单抗(inebilizumab)可耗竭大部分B细胞。间接抑制B细胞的药物还有靶向BAFF的贝利尤单抗(belimumab)、靶向BAFF/APRIL受体的阿塞西普(atacicept)。以及可引起高活性浆细胞凋亡的蛋白酶体抑制剂,如硼替佐米。
调控Fc和FcRn(图3D)
Fc受体参与抗体介导的效应器功能和补体激活,IVIg制剂即通过上调各类免疫细胞上携带的抑制性FcγRIIB受体抑制炎症。IgG循环路径则由FcRn参与,efgartigimod即是一种FcRn拮抗剂,可促进IgG降解。
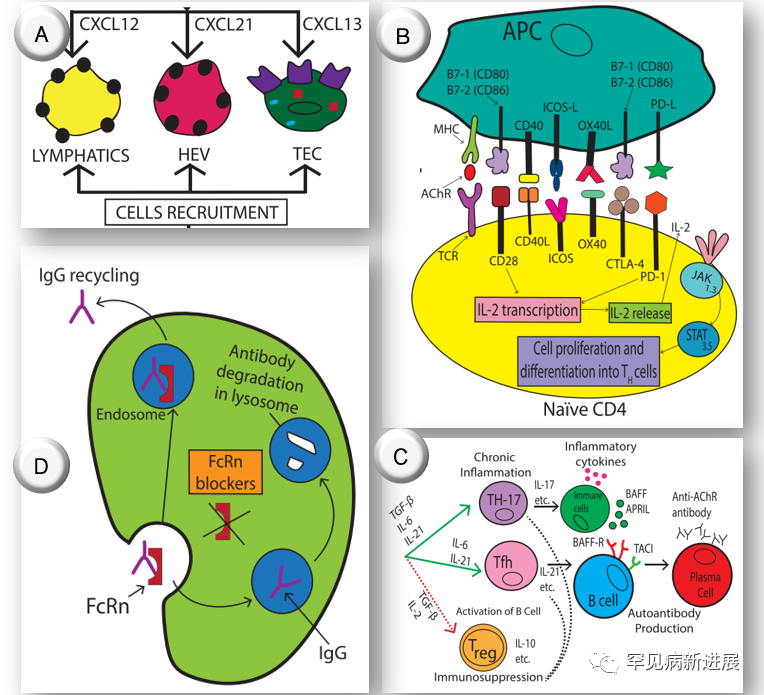
图3. MG潜在疗法示意图