A型血友病是一种因凝血因子FVIII缺乏引起的与出血相关的先天性疾病。预防是目前对具有严重表型的血友病A患者的标准治疗;然而,使用需要频繁静脉内给药(>1次/w)的FVIII预防,由于出血控制不佳,另有产生抑制剂的可能,预防治疗负担高且复杂,在亚太地区的发展中国家情况尤为突出。Emicizumab是一种治疗血友病A的人源化双特异性单克隆抗体,可连接活化因子IX(FIXa)和因子X(FX),替换缺少激活的FVIII和恢复止血的功能。其较长的半衰期允许更长的治疗间期,再加上皮下给药途径和高生物利用度,对患者的负担较轻,并提高了对预防性治疗的依从性。本文报告了亚太地区预防性应用emicizumab治疗血友病A(HAVEN5研究)的中期数据[1]。

方法
研究设计 HAVEN5是一项随机、多中心、开放标签、3期临床研究,在中国、马来西亚和泰国的13个地区进行。研究参与者被随机分配到3个治疗组:在A组(1.5mg/kg,1次/w)(A组)或B组(6mg/kg,1次/4w)维持剂量前4周应用3mg/kg,1次/周(负荷剂量),C组则不进行预防(图1)。在完成24周的研究后,C组参与者可以改用emicizumab治疗(负荷剂量+维持剂量)。A和B组患者可以继续维持剂量治疗。如果他们的出血控制不佳(emicizumab给药前24周期间发生的有临床意义的≥2次自发出血事件,且均发生在负荷剂量期结束后)则增加剂量(3mg/kg,1次/w)。 图1
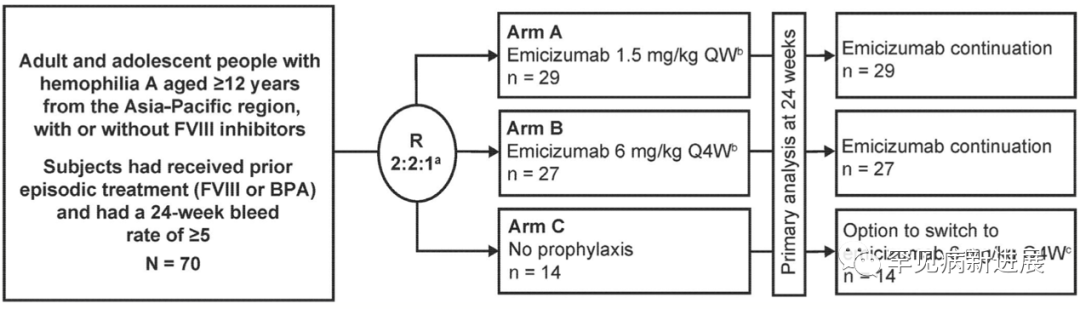
受试者
HAVEN5研究的纳入标准包括:年龄≥12岁的严重血友病A(内在FVIII水平<1%)或存在FVIII抑制剂的血友病A患者(非抑制剂患者≤55位);在进入研究前24周内有≥5次出血记录并间断接受过治疗(FVIII或旁路途径药物BPA);成功完成免疫耐受诱导(ITI)治疗且没有FVIII抑制剂(<0.6BU/mL)的受试者必须在筛查前≥5年完成,并且自ITI以来没有永久性/暂时性抑制剂复发的证据(>0.6BU/ml)。排除标准:除血友病A以外的遗传性或获得性出血性疾病、血栓性微血管病(TMA)高风险和/或有血栓事件(TE)迹象或先前/当前治疗TE的患者被排除在外。
结局指标 主要疗效终点是A、B、C组的血友病A患者治疗出血的年化出血率(ABR)。次要疗效终点是接受每周一次或每4周一次emicizumab预防与未预防的受试者相比的所有出血和治疗自发/关节/目标关节出血的ABR。如果出血属于同一类型并且在第一次出血停止治疗后72小时内发生在同一解剖位置,则将其计为一次出血(“72小时规则”);手术/手术引起的出血被排除在外。根据ISTH的定义,目标关节被定义为在24周内发生≥3次出血事件的主要关节。还评估了未预防与24周emicizumab预防后健康相关生活质量(HRQoL)和健康状况(EQ-5D-5L)相对于基线的变化。不良事件(AE)的发生率、严重AE(SAE)、导致治疗中断/修改/中断的AE、注射部位反应(ISR)、特殊感兴趣AE(AESIs)和抗药物(emicizumab)抗体(ADA)用于评估安全性。通过每周一次和每4周一次的药代动力学(PK)采样表征emicizumab治疗后的暴露。 结果
从2018年4月26日到2019年1月4日,共有76名A型血友病患者接受了资格筛查,其中70人参加了这项正在进行的研究。参与者分别以2:2:1的比例随机分配到A(n=29)、B(n=27)和C(n=14)组。在完成24周的研究后,C组的13名参与者转而接受3mg/kg,1次/周连续4周的负荷剂量后每4周接受6mg/kg的emicizumab;由于在接受3mg/kg负荷剂量时发生头痛,一名受试者每周接受1.5mg/kg的emicizumab。研究者认为该1级(非严重)AE与治疗相关。在出血控制不佳后,将一名参与者(B组)的治疗剂量在第25周上调至3mg/kg,1次/周。截至临床报告分析的截止日期(2019年6月21日),所有受试者(n=70)已完成至少24周的研究,且均继续使用emicizumab。ITT和安全评估包括所有随机参与者。由于管理原因,未分析六名参与者的PK和ADA样本。ITT中的大多数参与者(所有治疗组中≥85.7%)完成了所有预定的BMQ、Haem-A-QoL(>18岁使用的生活质量问卷)和EQ-5D-5L评估。然而,只有63.6%(11名12-17岁参与者中的7名)完成了所有的Haemo-QoL-SF(适用于12-17岁的生活质量问卷)评估;因此,未提供这些数据。
有效性
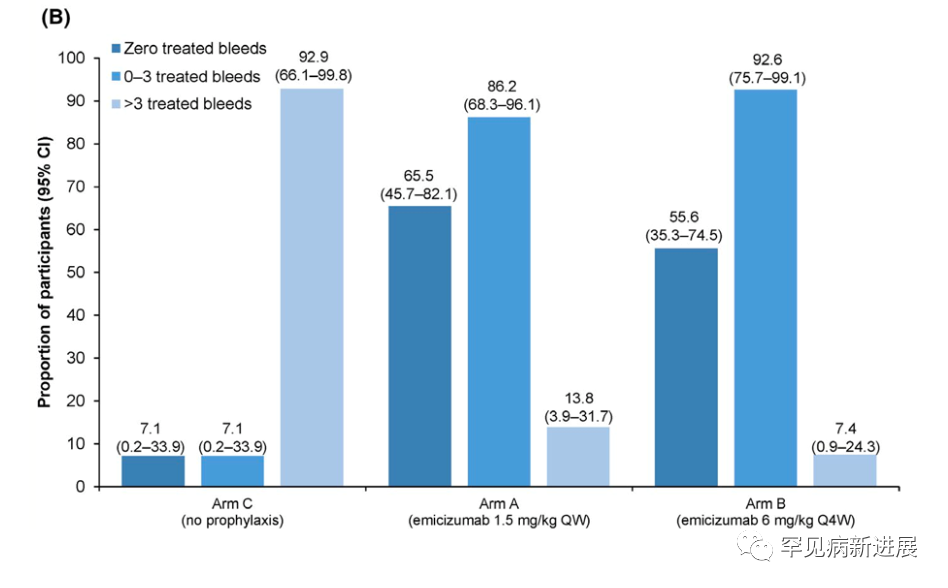
所有参与者均为男性,中位(范围)年龄为29.0(12-66)岁,大多数为中国人(85.7%)。大多数受试者在基线时患有严重的血友病A(95.7%)和靶关节(74.3%)。进入研究前24周的中位(范围)出血次数为14.5(5-39)。在基线时,共有16名(22.9%)受试者存在FVIII抑制剂,54名(77.1%)没有抑制剂;此外,3名FVIII抑制剂的参与者之前接受过ITI治疗(B组,n=2;C组,n=1)。A组的中位(IQR)有效期为43.7(36.14-48.43)周,B组为46.1(36.71-49.29)周,C组为24.0(24.00-24.29)周。两种emicizumab方案均达到了主要疗效终点;在emicizumab预防后,A组治疗出血的ABR(95%CI)为1.0(0.53-1.85),B组为1.0(0.50-1.84),而C组为27.0(13.29-54.91)。因此,与不采取预防措施相比,emicizumab治疗出血的ABR降低了96%,具有统计学意义和临床意义(P<0.0001;图2A)。且在治疗的前24周内分别为65.5%(A组)和55.6%(B组)参与者的治疗出血为零,而未接受emicizumab的参与者为7.1%(图2B)。与未采取预防措施相比,两种emicizumab方案均达到了其他与出血相关的终点;观察到ABR有≥95%的统计学显著降低(P<0.0001)。在A组和B组中,经治疗的自发性出血、关节出血和目标关节出血的ABR值均为零。使用emicizumab后Haem-A-QoL身体健康评分和总评分从基线下降,表明HRQoL有所改善(均值(95%CI):A组,-20.20[-12.02~-28.38];B组,-22.14[-14.82~-29.47];C组,-5.63[-6.08~-17.33];总分:A组,-10.14[-3.46~-16.81];B组,-17.61[-10.96~-24.25];C组,-2.50[-3.74~-8.75])。
图2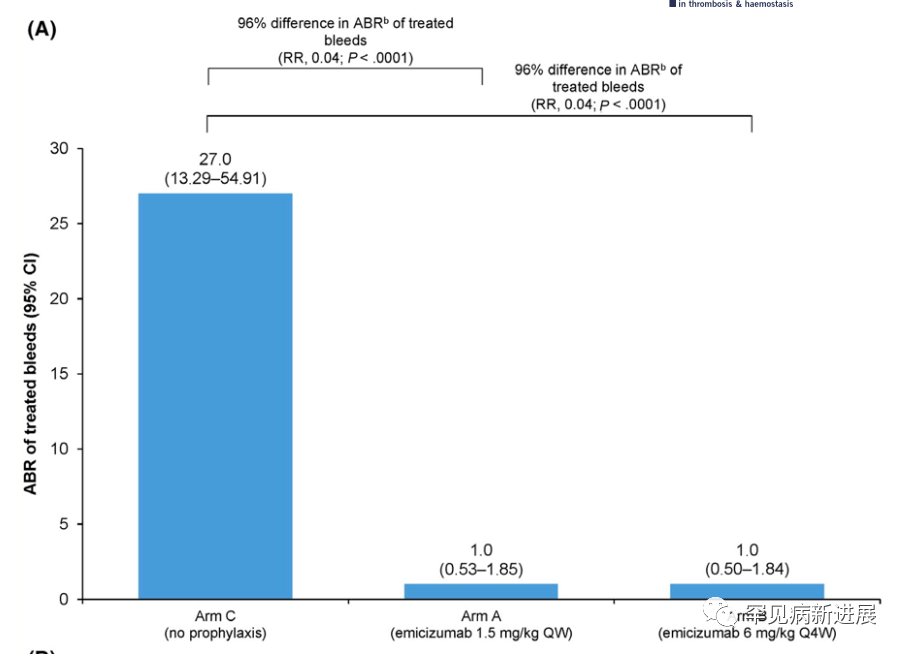
安全性
总共有44名受试者在治疗后报告了185例AE(A组,n=109;B组,n=76),C组中的2名参与者在未进行预防时报告了3例AE。大多数(78.6%)接受emicizumab治疗的参与者报告了至少1次AE,而未采取预防措施的参与者为14.3%;大多数AE为1级或2级。上呼吸道感染是最常报告的AE(A组,n=9[31.0%];B组,n=5[18.5%];C组,n=2[14.3%])。A、B和C组的参与者分别报告了13.8%、18.5%和0%的局部ISR。3名参与者(A组,n=2[6.9%];B组,n=1[3.7%])共报告了4次SAE,但均报告与研究治疗无关:一名出现胰腺炎和腹腔内出血,以及关节痛和支气管扩张感染性加重。报告了两个潜在的AESI,随后被排除在外。研究期间未报告死亡、TE、TMA或生命体征较基线的临床显著变化;大多数参与者的血液学参数是稳定的。在64名可评估受试者中有8(12.5%)位出现ADAs(A组,n=4/25[16.0%];B组,n=4/25[16.0%];C组[在emicizumab治疗后],0/14[0.0%]),其中仅一名受试者ADA具有中和潜力(即与emicizumab血浆浓度降低相关)。该参与者在第4周首次检测出ADAs阳性,从第14周开始观察到emicizumab浓度下降;然而,从第34周开始,暴露量明显恢复。对于其他7名参与者,没有观察到对PK的影响或对出血的临床相关影响。每周一次和每4周一次的emicizumab给药方案实现了持续有效的血浆谷浓度;平均谷血浆浓度随着负荷剂量增加至39.8μg/mL(每周一次)和43.5μg/mL(每4周)直到第5周,然后维持在38μg/mL和33μg/mL,直至第49周(图3)。
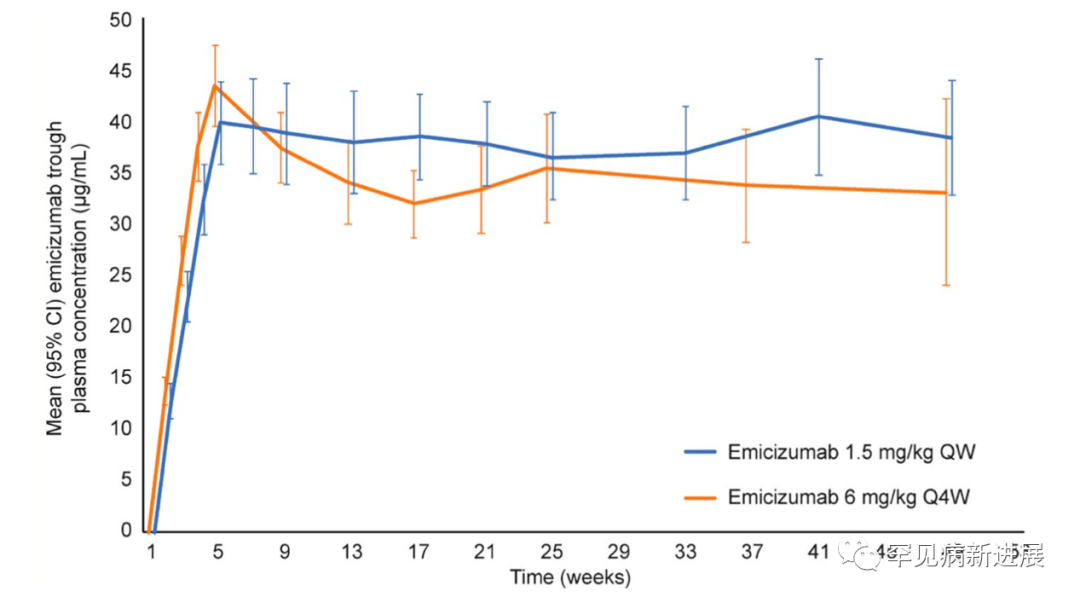
结论
HAVEN5达到了主要疗效终点,同时证明总体有利的安全状况。在来自亚太地区的A型血友病成人和青少年患者中,无论FVIII抑制剂状态如何,与未进行预防相比,Emicizumab预防实现了高效的出血控制,治疗的ABR显著降低。预防耐受性良好,没有死亡、TE、TMA或新的安全信号。同时观察到的emicizumab暴露量较低并未影响emicizumab在亚太地区A型血友病患者中的疗效。这些可靠的疗效和安全性数据,再加上HRQoL临床显著改善,表明emicizumab可以通过减少治疗负担来改善患者护理,这反过来可以提高对有效预防的依从性,从而可能减少继发性并发症的发生。