除了骨髓移植,阵发性睡眠性血红蛋白尿症(PNH)尚无其他有效治愈手段,控制溶血发作是临床上治疗该病的主要手段。十多年来C3靶向药物的开发成为提升PNH治疗的新策略,2021年美国FDA已批准首款C3补体抑制剂Empaveli(Pegcetacoplan)上市。本文旨在梳理C3靶向策略在治疗PNH上取得的研究进展,及当前可预见的仍待优化的层面。

靶向C3的临床前证据
长久以来,C3靶向策略并不被看好,因为其在血浆细胞中的表达水平偏高,约1 mg/mL,且分子量过大(183 kDa)。临床前体外研究尝试了三种思路开发抑制或调整C3的药物,均证实有望达到较佳的溶血控制。
抗C3单克隆抗体
通过对C3片段的特异性活化,阻断C3介导的扩增循环,以期在PNH治疗中发挥抑制病理症状的作用。只是因为这些抗体同时也参与调节红细胞,无法成为治疗之法。进而考虑到,利用这些抗体的抗原结合片段(Fab)衍生物或可用于治疗补体介导的溶血性贫血、肾脏疾病。
靶向C3的工程蛋白
这是一类可发挥补体抑制剂作用的工程融合蛋白,其结构上包括内源性补体抑制剂的融合域,及能够识别补体激活位点蛋白域。如,基于补体H因子对旁路途径的双重调节作用,TT30工程蛋白可与补体受体在iC3b/C3dg区域结合;经体外模型验证后,进入临床1期试验,并被证实对PNH患者血管外溶血的抑制作用。但是,却因药效过于短暂而放弃。
靶向C3的多肽
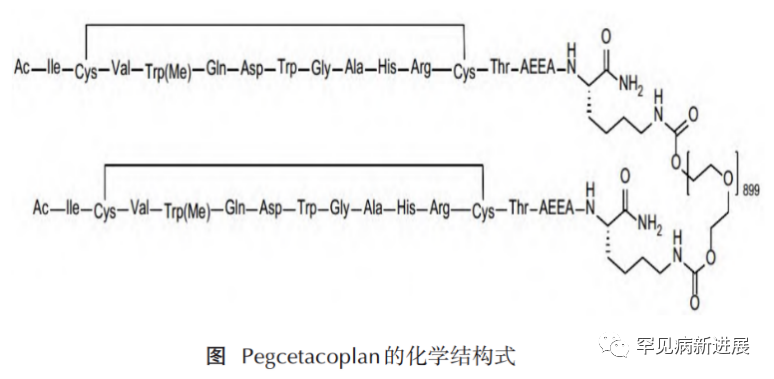
以小分子肽类抑制C3的研究由John Lambris教授于25年前开展,找到一种合成环肽compstatin,对人类和灵长类C3具有很强的亲和力和选择性,可在C3水平上集中抑制补体,并阻断补体激活级联的所有下游通路。至今已开发至第四代。其中,AMY-101和新兴的第4代compstatin通过在C3水平上集中抑制补体,在治疗多种补体介导的疾病方面可能比部分补体抑制剂(如抗C5药物)或其他C3抑制剂更有效。而已经获批上市的APL-2(Pegcetacoplan)即是另外一种聚乙二醇化的Compstatin类似物。
Pegcetacoplan的临床证据
C3靶向性抑制剂Pegcetacoplan上市的剂型为注射剂,规格 1080 mg/20 mL,可特异性地与补体C3 和 C3b 结合,从而抑制补体C3裂解为活性片段发挥作用;同时,Pegcetacoplan 还能与已产生的活性片段 C3b 结合,抑制其激活下游效应的产生,主要表现为抑制C3b介导的血管外溶血和末端补体介导的血管内溶血。
临床I/II试验
PADDOCK 试验是在新西兰、泰国、马来西亚和香港进行的一项开放标签、多次递增剂量的Ⅰb期临床研究,旨在评估 Pegcetacoplan 作为单药治疗 PNH 患者的安全性、耐受性和疗效。该研究分为2个队列。队列 1 中有 3 例 PNH 受试者,从第1-28天,每日1 次皮下注射 180 mg药物;队列 2 中有 20 例 PNH 受试者,从第 1-364 天,每日 1 次皮下注射 270 mg 药物,如果临床反应欠佳,剂量可增加至每天360 mg。28天时的试验结果显示,受试者LDH平均基线从第1 天的 2459 U/L降低到第 29天的 197 U/L。网织红细 胞绝对计数平均基线从193×109 /L 降低到 89×109 /L、总胆红素从39 µmol/L降低到10 µmol/,Hb 从基线中位数 80 g/L 增加到 108 g/L。本项试验结果提示 Pegcetacoplan 的潜在优势是血管外溶血减少,且安全性和耐受性良好。
PHAROAH 是开放标签、Ⅰb期、前瞻性、非随机、单次和多次递增剂量的试验,旨在评估在使用依库珠单抗治疗期间仍有贫血的 PNH 患者中同时给予 Pecetacoplan 治疗的安全性、耐受性和药物代谢动力学。该研究中的队列4,共纳入中 6 例 PNH 患者,皮下注射270 mg药物,每日1次,治疗时间长达2年;其中6例 PNH 患者共报告了 427 次治疗期间出现的不良事件,68 次被认为可能与药物有关,并且 48 次报告为注射部位的不良事件。
临床III试验
在Pegcetacoplan的随机、开放标签、多国的Ⅲ期临床研究中,53 例患者随机分为治疗组和标准护理组,治疗组每周 2 次皮下给予1080 mg 药物治疗,试验共进行了 26 周;试验结束时,疗效良好,治疗组实现了血红蛋白稳定,平均 LDH 为 211 U/L在正常范围内,且与标准护理组相比,其平均LDH 水平较基线下降的幅度比标准护理组更大。
在Pegcetacoplan另一项为期48周的、随机、多中心、开放标签、活性对照Ⅲ期临床试验PEGASUS中,共纳入80例PNH患者,主要目的是评价在血红蛋白水平低于 105 g/L 的 PNH患者中,Pegcetacoplan 与依库珠单抗相比的有效性和安全性。研究试验结果显示Pegcetacoplan治疗组的血红蛋白水平从基线到第 16周的变化优于依库珠单抗治疗组,调整后(最小二乘法)平均差异为 38.4 g/L。治疗组有 35 例患者(85%)不再需要输血,而依库珠单抗治疗中仅有 6 例患者(15%)不再需要输血。在网织红细胞绝对计数的变化上Pegcetacoplan治疗组非劣于依库珠单抗治疗组,在乳酸脱氢酶水平的变化上没有显著性差异。
仍待关注的治疗问题
PNH 是一种超级孤儿且危及生命的疾病,其特征是溶血、骨髓衰竭和血栓形成。基于这些临床证据,Pegcetacoplan先后获美国FDA和欧盟EMA批准用于PNH的治疗,是补体疗法在临床应用的一个重要里程碑,意味着靶向C3治疗时代的到来,但一些新的关注也正进入医学视野。
研究终点指标的选择
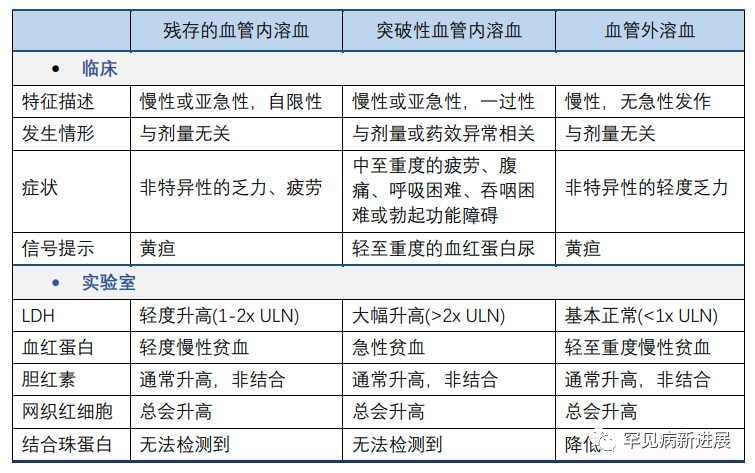
相比C5抑制剂,靶向C3更有效地改善了C3介导的血管外溶血;为在临床试验中更好地判定疗效,血红蛋白水平、贫血改善被提出或可作为特异性的疗效评价。如前所述的PEGASUS研究中,血红蛋白水平即被纳入为研究终点;而在依库珠单抗等C5抑制剂的临床疗效观察中,则主要以LDH为最佳的疾病标志物。按依库珠单抗上市后近些年的临床应用可知,LDH虽可代表疾病状态,但作为临床试验的研究终点欠佳,因为患者即使LDH水平正常,仍可能发生贫血、血栓。此外,LDH在血液中并不稳定,当LDH水平已经极低的情况下,如小于1.5倍的正常值上限,其继续改善缺少临床意义。血红蛋白水平变化则更适合追踪血管内、外溶血。因此有一种观点提倡,在抗补体治疗PNH中,应纳入广泛的血液学疗效评价,如输血需求、血红蛋白水平、LDH和网织红细胞计数。近来的很多PNH研究已经开始这样做,较少单独使用LDH指标判定疗效。然而,LDH保留了其作为药效生物标记物的主要作用,可跟踪血管内溶血的再次出现。
对突破性溶血的重视
与未经治疗的PNH患者经历的急性血管内溶血不同,经补体抑制剂治疗的PNH患者在溶血得到控制后,再复发的血管内溶血才称为突破性溶血。尽管早在C5抑制剂治疗中就已经关注到这一问题,但对其临床指标上的定义仍未达成共识。由体外试验数据可知,当大量补体处于激活状态时,或补体抑制剂浓度较高时,会有细胞溶血状态,这可能和药物动力学、药效学相关。对Pegcetacoplan治疗相关的突破性溶血仍知之甚少,PEGASUS研究中报告了4例这样的患者;也有观点认为,其中对突破性溶血的定义欠妥当,因为近来发现Pegcetacoplan所引发的突破性溶血要比依库珠单抗所引发的更严重,甚至导致治疗终止。这提示后续仍需深入研究其机制,并寻求可能的风险管理方案。如,当接受治疗的患者LDH> 2xULN时,Pegcetacoplan说明书建议调整剂量至1080mg/3天,这或适用于慢性、残存溶血的患者,对突发、重症溶血风险仍不足以保障。其它可考虑的安全措施还包括,短期联用C5抑制剂,或再调整Pegcetacoplan剂量。
其它不良反应,如感染、血栓
现有研究数据显示,使用Pegcetacoplan并未显著增加PNH患者的感染风险,这可能得益于对荚膜菌所引发疾病的预防接种,及抗生素使用的控制。需要注意到,有些国家地区抗生素类药物仍有广泛使用,甚至接受补体抑制剂治疗的患者仍可能接受到抗生素药物的其它治疗。所以,临床上仍需谨记补体抑制剂对免疫系统的改变,一旦发现患者有任何感染迹象予以及时处理。通常我们认为,当长久、持续地控制补体介导的血管内溶血时,应采取其它措施预防血栓形成。尤其是在接受Pegcetacoplan治疗中,发生突破性溶血的患者,可能意味着更高的血栓形成风险。
附表性总结
表1. 治疗PNH的两类补体抑制剂比较
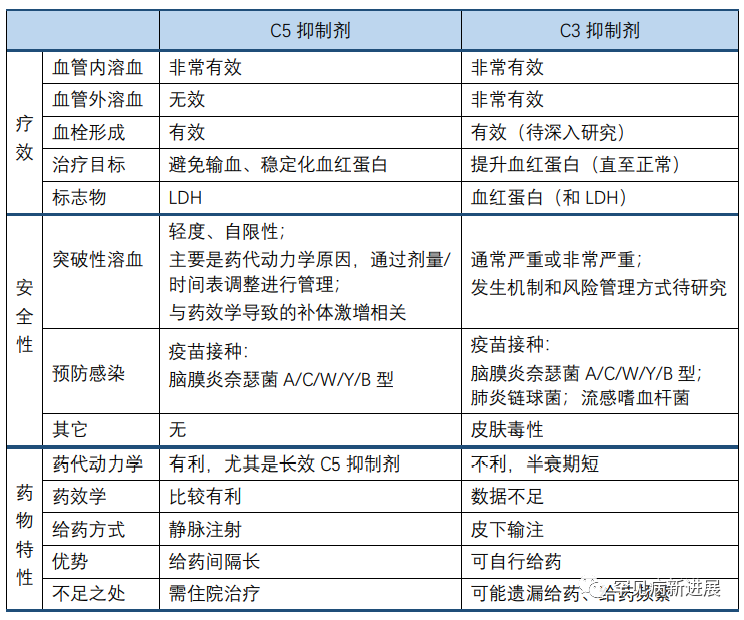
表2. 补体抑制剂治疗PNH中的溶血