
2022年7月15日,中国专注于眼科疾病的体内基因治疗领导者纽福斯生物科技有限公司(下称“纽福斯”)宣布公司核心产品NR082眼用注射液(rAAV2-ND4, NFS-01)正式被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种。
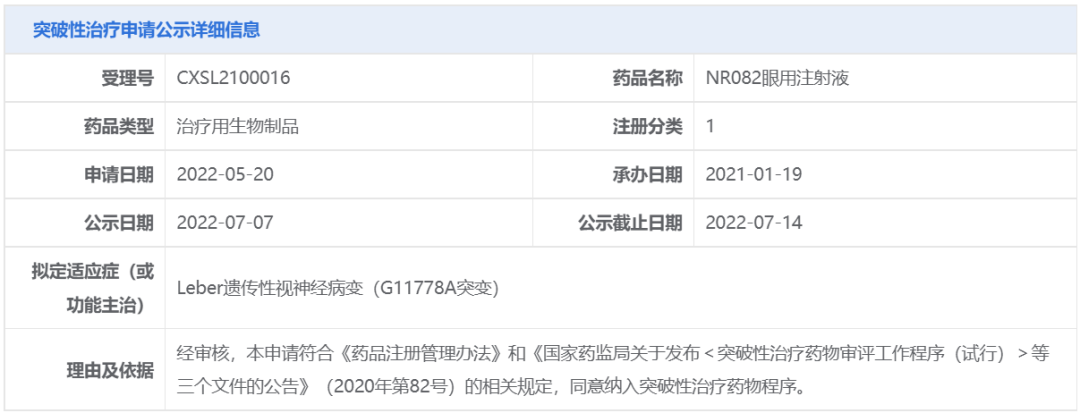
CDE官网公示信息
纽福斯的核心产品NR082是一种重组腺相关病毒血清型2载体(rAAV2)的新型眼内注射基因治疗产品,正在开发用于治疗ND4突变引起的Leber遗传性视神经病变(LHON),目前在中国进行I/II/III期注册性临床试验。NR082采用基因治疗策略,以重组腺相关病毒作为载体,通过单次玻璃体内注射,将正确的基因通过玻璃体腔注射递送至患者受损的视神经节细胞,修复线粒体生物呼吸链,使视神经节细胞恢复活力与视功能。
突破性疗法是指用于防治严重危及生命或严重影响生活质量的疾病,且对于尚无有效治疗手段的,该药物可以提供有效防治手段或与现有治疗手段相比具有更明显的临床优势。突破性疗法认定旨在鼓励研究和创制具有明显临床优势的药物,CDE会为获评疗法提供一系列政策支持,包括临床试验研制指导,优先配置资源进行沟通交流,加强指导并促进药物研发进程,上市申请优先审评审批等。
纽福斯创始人、董事长兼首席执行官李斌教授表示:“这一突破性疗法的认定是纽福斯及NR082的重大里程碑,也是中国基因治疗解决Leber遗传性视神经病变未满足临床需求的重要一步。CDE的进一步认可和支持将帮助我们加速NR082临床开发和商业化进程。我们有信心更快更好地在中国进行III期临床试验并快速推动美国临床试验,团队上下将毫无保留全力推进NR082早日上市,让这一革命性的创新疗法点亮患者的生活。”
纽福斯副总裁、全球药政事务负责人陈一元表示:“NR082曾获得FDA和欧洲药品管理局(EMA)孤儿药认证,NMPA首个眼科体内基因治疗药物的IND许可以及美国IND许可,我们非常高兴NR082再次获得CDE授予的突破性治疗品种的认定。这更令我们坚定了推动NR082成为中国首个上市的眼科体内基因治疗药物的信心。我们将再接再厉,希望这个新的基因治疗手段能早日惠及中国及全球的患者。”