2022年6月13日,RNAi疗法先锋公司Alnylam Pharmaceuticals宣布,美国食品和药物管理局(FDA)批准AMVUTTRA™(vutrisiran)上市。AMVUTTRA™(vutrisiran)是一种RNAi疗法,通过皮下注射,每三个月(季度)一次,用于治疗成人遗传性转甲状腺素介导的(HATTR)淀粉样变的多发性神经病。

Vutrisiran已在美国和欧盟(EU)被授予 "孤儿药 "称号,用于治疗ATTR淀粉样病症,在日本被授予治疗转甲状腺素型家族性淀粉样病症与多发性神经病症。目前该药正在接受欧洲药品管理局(EMA)、巴西卫生监管局(ANVISA)和日本药品与医疗器械管理局(PMDA)的审查。

遗传性转甲状腺素介导的(HATTR)淀粉样变性是一种遗传性的、逐渐衰弱的、致命的疾病,是一种主要的未满足的医疗需求,由TTR基因的变异(即突变)引起。TTR蛋白主要在肝脏中产生,通常是维生素A的载体。TTR基因的变异导致异常的淀粉样蛋白积累并损害身体器官和组织,如周围神经和心脏,导致顽固的周围感觉-运动神经病变、自主神经病变和/或心肌病,以及其他疾病表现。hATTR具有显着的发病率和死亡率,全球约50,000人患病,诊断后的中位生存期为4.7年,心肌病患者的生存期缩短(3.4年)。
FDA批准AMVUTTRA™(vutrisiran)上市是基于历时9个月的HELIOS-A三期研究结果,AMVUTTRA明显改善了多发性神经病的症状和体征,超过50%的患者疾病表现得到了停止或逆转。HELIOS-A 3期研究曾在今年4月的美国心脏病学会(ACC)第71届年会上展示。
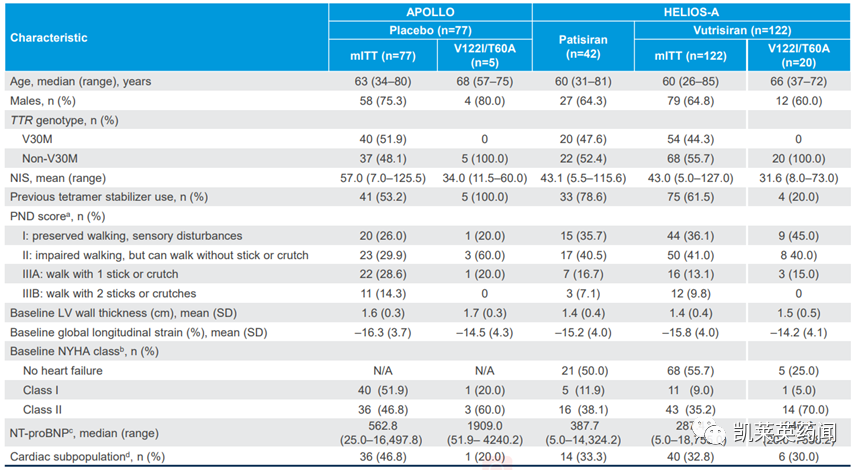
HELIOS-A是一项全球随机、开放、多中心的三期研究,以评估AMVUTTRA在不同HATTR淀粉样变性伴多发性神经病变患者群体中的疗效和安全性。研究共纳入164名患者,实验组与对照组随机以3:1比例分配,实验组接受每三个月一次25毫克vutrisiran皮下注射(N=122),对照组接受每三周一次0.3毫克/公斤patisiran的静脉注射(N=42),为期18个月。
AMVUTTRA达到主要终点,即9个月时改良的神经病变损伤评分+7(mNIS+7)从基线的变化。使用AMVUTTRA治疗(N=114)导致mNIS+7比基线平均下降(改善)2.2分,而外部安慰剂组(N=67)报告的平均上升(恶化)14.8分,导致相对于安慰剂的平均差异17.0分(P<0.0001);到9个月,50%使用AMVUTTRA治疗的患者的神经病变损伤相对于基线有所改善。
AMVUTTRA同样在9个月时达到了研究的所有次要终点。相较对照组,实验组诺福克生活质量问卷-糖尿病神经病变(Norfolk QoL-DN)评分和定时10米步行测试(10-MWT)都有明显改善,探索性终点包括改良体质指数(mBMI)从基线的变化也有改善。18个月的疗效结果与9个月的数据一致,与安慰剂相比,AMVUTTRA在所有主要终点与次要终点(包括mNIS+7、Norfolk QoL-DN、10-MWT和mBMI)上都取得了统计学上的显著改善,并且相对于研究范围内的patisiran参考组,血清TTR的减少也是非劣效的。
此外AMVUTTRA还显示出令人鼓舞的安全性和耐受性。用药9个月,没有出现与药物相关的停药或死亡。AMVUTTRA治疗的患者最常报告的不良事件(AE)包括关节痛(11%)、呼吸困难(7%)和维生素A减少(7%)。有5名患者(4%)报告了注射部位反应(ISRs),都是轻微的和短暂的。
在美国,vutrisiran已根据2022年4月14日的处方药使用者费用法案(PDUFA)获得行动日期,预计将于7月初向美国的医疗机构发货。Alnylam公司计划为hATTR淀粉样变患者提供Alnylam Assist™支持服务计划,成立一个专门帮助患者核实保险福利的团队,并为符合条件的患者提供经济援助。患者教育联络员帮助患者解答关于疾病和治疗的问题。

AMVUTTRA™(vutrisiran)还在进行两项研究
HELIOS-A(一年两次50mg给药方案):在正在进行的HELIOS-A试验的随机治疗延长期(RTE)内,正在评估一年两次的50毫克给药方案。
HELIOS-B(治疗ATTR淀粉样变性伴心肌病):Vutrisiran还在HELIOS-B三期研究中被评估用于治疗ATTR淀粉样变性伴心肌病患者,包括HATTR和野生型ATTR(wtATTR)淀粉样变性。ATTR疾病或病症影响美国不到20万人。
除Alnylam公司外,另一家反义寡核苷酸疗法(ASO)巨头Lonis也在今年3月宣布,其管线中用于治疗转甲状腺素蛋白淀粉样变性患者的研究性反义药物Eplontersen被FDA授予孤儿药资格认定。目前 Eplontersen正在进行转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)和转甲状腺素蛋白淀粉样变性多发性神经病(ATTR-PN)的3期临床试验。2021年12月,Lonis宣布与阿斯利康公司达成战略合作,开发和商业化Eplontersen。
期待更多小核酸药物上市,为更多患有罕见重疾病患者带来希望。