美国1983年国会通过颁布的《孤儿药立法》,又称《Waxman法案》来纪念主要提出这份法案的国会议员亨利Waxman。
这份法案的里程碑之处,就在于,正式确定了罕见病新药,孤儿药的七年市场独占期。
这个法案如此重要,随着罕见病患者和对罕见病认识的不断提高,各国都纷纷效仿颁布了自己的孤儿药法。
比如,1993年,日本国会通过了孤儿药的立法,2000年,欧盟也通过了类似的法律。
在刚刚公布的《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》,明确规定,“对批准上市的罕见病新药,在药品上市许可持有人承诺保障药品供应情况下,给予最长不超过7年的市场独占期,期间不再批准相同品种上市。药品上市许可持有人不履行供应保障承诺的,终止市场独占期。”

(FDA定期发布罕见病新药发展指南,指导和鼓励发展孤儿药)
孤儿药:史无前例发展
除了各国的纷纷效仿,研发和工业界也笑逐颜开。
孤儿药出现了史无前例的大发展。
这个孤儿药法的特点在哪里呢?
首先,不同于传统的新药专利法,这个孤儿药法授予的市场独占期是在药物获得 美国食品药品监督管理局FDA 批准后才开始。
而且,独立于药物当前的专利状态。
因此,这个7年是单独的不参合任何时间的净七年。让孤儿药可以安安静静独享市场独占的风光无限。
第二,如果市场竞争者希望针对相同的适应症推出一种新的药物,则竞争者有责任证明其药物与适用于该适应症相比现有药物相更具有治疗优势,例如提高疗效、降低毒性等。
两个最大亮点,一个最终目标,激励罕见病孤儿药大发展,为有兴趣为任何特定罕见疾病开发产品的公司创造了一个有吸引力的垄断市场。
(FDA专门设立了孤儿药办公室ODD,定期颁布孤儿药的新药资格认定)
立法的当年,1983年的节点,只有38个孤儿药获得批准上市。
到了2014年,373个孤儿药,治疗468种罕见疾病在美国获批。
当然,除了立法的鼓励刺激以外,还有其他的一系列配套措施,在税收的诸多方面,帮助罕见病孤儿药的发展。
这其中包括:政府代表孤儿药开发的奖励政策也可以采取以下多种形式:
税收优惠
加强专利保护和营销权
临床研究补贴
创建国有企业从事研发
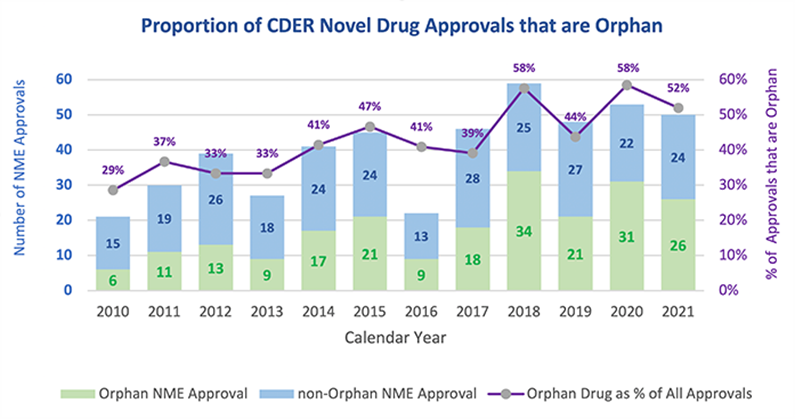
(罕见病药获批连年创新高。2018年,FDA一半多的获批新药都是孤儿药)
除了工业界,研发行业,投资人也欣喜若狂。
2013年,在纪念孤儿药法通过30年之际,国会议员,这个法案的最重要的提倡者,亨利Waxman在回顾这个法案时,这样表示道:
“[制药] 行业利用激励措施收取超额利润并获得远远超过其药物投资的意外收获。”
-Orphan Drug Act Chief Sponsor Henry Waxman
正是这个激励政策带来的政策红利,所谓的意外的收获,超额利润,才诞生了一大批至今我们耳熟能详的公司。
新药巨头涌现
就是传统药企,也开始转变态度,对罕见病孤儿药刮目相看。
辉瑞公司,专门于2010年成立了孤儿药部门,投入专业的团队和大批的预算来研发罕见病的新药治疗。

(ODA立法让许多药企重视孤儿药,罕见病新药进入史无前例的大发展)
健赞(Genzyme)公司,一个波士顿的生物药企,十年磨一剑, 把酶替代疗法(ERT)做到极致,把一个又一个新药,思而赞,美而赞带到患者目前。
后来,法国药企赛诺菲(Sanofi)也动了心,大手笔收购了健赞。
Amicus,罕见病老爸创业,成立的一家药企,最后一举上市。
Alexion,专注血液,代谢紊乱的罕见病,Soliris成为主打生物大药,被阿斯利康收购。
Actelion,专注肺动脉高压治疗,被强生收购
爱尔兰药企Shire
瑞典药企Sobi。。。
这个刚刚公布的新政,是否也能催生中国的孤儿药新药巨头呢?
答案,应该在不远的将来就会见分晓。