Alport综合征-遗传性肾炎(图片来源:epainassist.com)
Reata Pharma是一家临床阶段的生物制药公司,致力于通过涉及细胞代谢和炎症调节的分子途径开发创新疗法,用于治疗严重或危及生命的疾病。近日,该公司宣布,美国食品和药物管理局(FDA)已针对bardoxolone methyl(bardoxolone)的新药申请(NDA)发布了一封完整回应函(CRL)。bardoxolone用于治疗由Alport综合征引起的慢性肾病(CKD)。目前,还没有药物被批准用于治疗Alport综合征引起的CKD。
CRL意味着,FDA不能以目前的形式批准NDA。根据审查,FDA得出结论,认为提交的数据不能证明bardoxolone在减缓Alport综合征患者肾功能丧失和降低进展为肾衰竭的风险方面的有效性,要求提供更多的数据,以支持bardoxolone的有效性和安全性。FDA的结论是基于FDA在简报中主要阐述、并在2021年12月8日召开的心血管和肾脏药物咨询委员会会议上讨论的疗效和安全性问题。
目前,bardoxolone也正在接受欧盟和日本监管机构的审查。bardoxolone是一种每日一次的、口服Nrf2激活剂。Nrf2是一种转录因子,可诱导恢复线粒体功能、减少氧化应激和抑制促炎信号的多个分子通路,促进炎症的消退。在美国,bardoxolone被授予了治疗Alport综合征和常染色体显性多囊肾病(ADPKD)的孤儿药资格(ODD);在欧盟,bardoxolone也被授予了治疗Alport综合征的ODD。
Alport综合征是一种遗传性肾炎,主要累及肾脏。该病是一种危及生命的疾病,尚无批准的疗法。如果获得批准,bardoxolone将成为第一个治疗Alport综合征的疗法。根据医药市场调研机构EvaluatePharma在2021年年初发布的一份预测报告,bardoxolone上市后的早期销售预计很少,但在2024年将迅速达到重磅(10亿美元)地位,预计销售额为11.2亿美元,2026年将进一步加速至25亿美元。
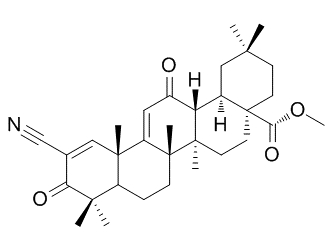
bardoxolone methyl分子结构式(图片来源:adooq.com)
bardoxolone的上市申请,基于CARDINAL 3期临床试验的疗效和安全性数据。这是一项双盲、安慰剂对照、随机试验,在美国、欧洲、日本和澳大利亚的大约50个研究地点招募了157名由Alport综合征引起的CKD患者。试验中,患者按1:1的比例随机分配,接受每日1次口服bardoxolone或安慰剂。研究第2年的主要终点是治疗100周后估算的肾小球滤过率(eGFR)较基线水平的变化。关键次要终点是第104周(治疗第2年最后一次给药后4周)时eGFR与基线水平的变化。
结果显示:在第100周和第104周,采用eGFR测定,与安慰剂组相比,bardoxolone治疗组患者的肾功能在统计学上有显著改善。在该研究中,bardoxolone耐受性良好,其安全性与先前试验中观察到的相似。所报告的不良事件(AE)一般为轻度至中度,与安慰剂治疗的患者相比,bardoxolone治疗的患者中最常见的不良事件是肌肉痉挛和转氨酶升高。
Alport综合征是一种罕见的遗传性CKD,由编码IV型胶原的基因突变引起。IV型胶原是肾脏肾小球基底膜的主要结构成分。Alport综合征影响儿童和成人,患者的肾脏逐渐失去从血液中过滤废物的能力,这可能导致终末期肾病(ESKD),需要进行慢性透析治疗或肾移植。在患有最严重疾病类型的患者中,25岁时透析率约为50%,40岁时透析率约为90%,60岁时透析率约为100%。根据Alport基金会(Alport Syndrome Foundation)的数据,Alport综合征影响美国约30000-60000人,目前还没有药物被批准用于治疗Alport综合征引起的CKD。
除了CARDINAL 3期研究外,bardoxolone目前也在FALCON 3期研究中评估治疗ADPKD患者、在MERLIN 2期研究中评估治疗有快速进展风险的CKD患者。
此外,日本药企协和麒麟(Kyowa Kirin)从Reata获得了bardoxolone授权,于今年7月在日本提交了治疗Alport综合征的申请。当前,协和麒麟也正在AYAME 3期研究中评估bardoxolone治疗糖尿病肾病(DKD)。截至目前,bardoxolone在治疗由ADPKD、IgA肾病、局灶节段性肾小球硬化、1型糖尿病引起的CKD患者中的2期研究已获得了积极结果。
原文出处:Reata Pharmaceuticals Receives Complete Response Letter From The FDA for Bardoxolone for the Treatment of Patients with Chronic Kidney Disease Caused by Alport Syndrome