肌萎缩侧索硬化症(ALS)是由大脑和脊髓运动神经元选择性变性引起的,然而,介导运动神经元死亡的主要细胞死亡途径仍不清楚。作者最近证实,坏死凋亡,一种调节细胞死亡的炎症形式,对于ALS小鼠模型中的运动神经元死亡是可有可无的,这意味着其他形式的细胞死亡。在这里,作者证实了ALS患者的这些发现,显示脊髓中缺乏关键的坏死效应蛋白的表达。

图片来源:https://doi.org/10.1038/s41418-021-00910-z
肌萎缩侧索硬化症的选择性运动神经元丢失可归因于多种细胞死亡途径,包括细胞凋亡、内质网应激诱导的细胞死亡、自噬细胞死亡和坏死性凋亡。在ALS人源化细胞共培养模型中的药理抑制和遗传消融研究已经确定了运动神经元死亡的非凋亡模式。在这里,作者证实了铁凋亡,一种最近被描述的铁依赖的RCD途径,介导了ALS中选择性运动神经元的死亡。
几十年来积累的多条证据,包括ALS受影响的中枢神经系统区域的铁积累、抗氧化失衡和脂质过氧化,都与铁死亡有关。此外,最近发现人类诱导的多能干细胞来源的运动神经元在体外发生铁死亡,而神经元gpx4消融则导致小鼠运动神经元死亡和瘫痪。最后,铁死亡的血液标志物,包括过氧化脂质、铁蛋白和转铁蛋白,与ALS预后相关。
在这里,作者无法在ALS患者和健康对照组的脊髓中检测到RIPK1和MLKL。这一结果与最初报道的肌萎缩侧索硬化症患者脊髓中RIPK1、RIPK3和MLKL的积聚和激活形成对比。虽然这可能反映了ALS患者群体的差异,如疾病异质性、组织收集和准备,但血源性细胞和免疫细胞浸润可能有助于中枢神经系统坏死标记信号,而不是反映真正的神经元或胶质细胞坏死。
Gpx4缺失在家族性和散发性ALS患者以及ALS的三种不同的遗传小鼠模型中都很常见,认为Gpx4失调在ALS中是普遍存在的。Gpx4下调不是神经变性的结果,因为在SOD1G93A小鼠的脊髓和皮质中,Gpx4水平提前下降,出现先兆症状和运动神经元丢失。
作者进一步研究发现Gpx4主要定位于脊髓中的运动神经元,与先前的研究一致,提示运动神经元中Gpx4的耗竭和铁性下垂是一种细胞自主效应。
为了证实铁死亡在体内介导运动神经元死亡中的直接作用,作者构建了新的BAC转基因人Gpx4小鼠。这些小鼠在所有被评估的组织中都过表达人gpx4,主要是在脊髓、脑和骨骼肌,这与gpx4在神经肌肉系统中的基本抗氧化和抗铁死亡作用是一致的。
研究结果发现SOD1G93A小鼠与转基因Gpx4小鼠杂交,双转基因小鼠的症状和病理均有改善。重要的是,Gpx4的过表达通过延迟疾病发作来延长生存期,这再次与ALS的细胞自主效应相一致。
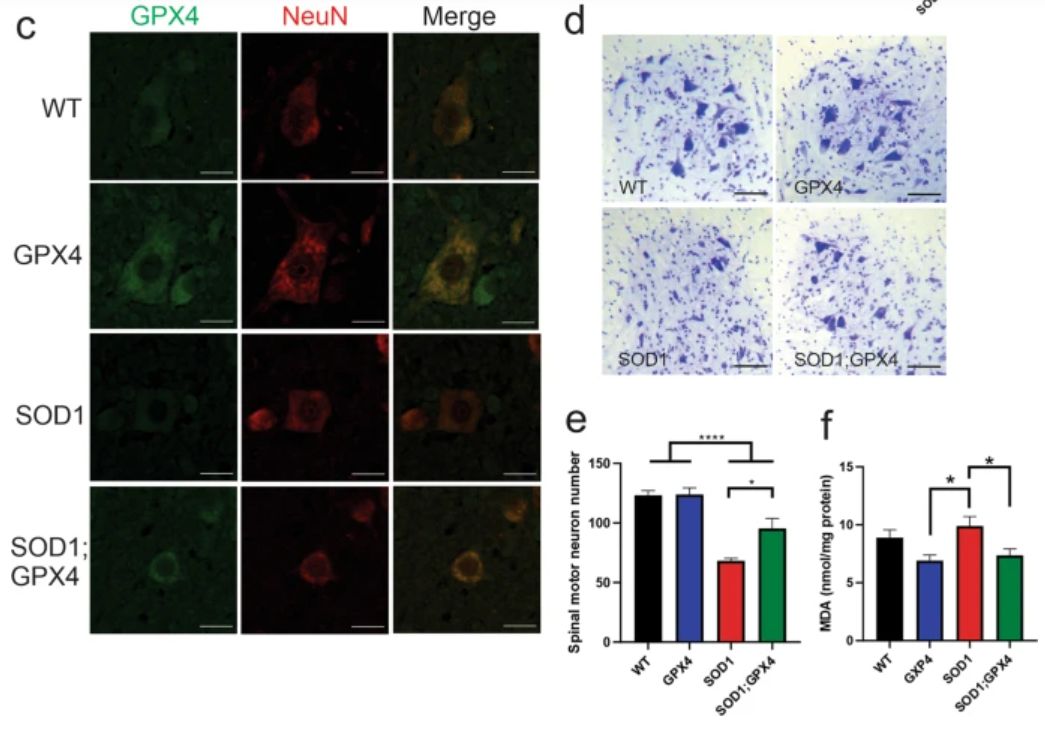
预防铁死亡可以挽救SOD1G93 A小鼠的运动神经元丢失
图片来源:https://doi.org/10.1038/s41418-021-00910-z
综上所述,本研究表明,在ALS患者和多种小鼠模型的脆弱中枢组织中,Gpx4介导的反铁联体防御功能受损。Gpx4过表达可恢复铁死亡防御,抑制脂质过氧化和运动神经元死亡,改善运动功能和预后。因此,Gpx4通路的药理学靶向和激活为ALS的潜在有效治疗提供了一条很有前途的途径。
参考文献
Taide Wang et al. Ferroptosis mediates selective motor neuron death in amyotrophic lateral sclerosis. Cell Death Differ. 2021 Dec 2. doi: 10.1038/s41418-021-00910-z.