近日,Global Blood Therapeutics(GBT)公司宣布,美国食品药品监督管理局(FDA)通过优先审查通道批准Oxbryta(voxelotor)片剂一项新药补充申请(sNDA),用于治疗4到12岁以下患有镰状细胞病(SCD)的儿童患者。该批准扩大了先前(2019年)批准的Oxbryta在美国治疗12岁及以上SCD患者的使用范围。与此同时,FDA还批准了该款药物口服分散片新药申请(NDA),该创新制剂是一种可分散,每日服用一次的新型片剂,用于治疗4到12岁以下患者以及无法吞咽片剂的老年SCD患者。

图片来源:drugapprovalsint.com
镰状细胞病是一种遗传性血红蛋白分子功能紊乱疾患,当血红蛋白分子暴露在各种环境中,红细胞血红蛋白发生聚合,扭曲变形成镰状,导致溶血性贫血、毛细血管和小血管阻塞,阻碍血液和氧气的全身循环,导致输送到下游器官和组织的氧气减少,引发危及生命的并发症,包括中风和不可逆的器官损伤 [1]。镰状血红蛋白(HbS)聚合是SCD中镰状细胞和破坏的根本原因。根据GBT公司官网显示,镰状细胞病(SCD)在美国超过10万患者,欧洲有52000人,全世界患者有数百万人。目前,Oxbryta是第一种(first-in-class)也是唯一一种直接针对镰状血红蛋白聚合批准的药物。

结构式来源:drugapprovalsint.com
Oxbryta的活性成分为voxelotor(GBT440),通过增加血红蛋白对氧的亲和力,阻断氧合的镰刀血红蛋白聚合化及红细胞镰状化,改善溶血性贫血和氧运输,并潜在地改变SCD发展的进程[3]。
该款产品扩大适应症的新药补充申请及口服分散片的NDA是基于开放标签2a期HOPE-KIDS1研究(GBT440-007)数据,详细数据可见FDA批准的Oxbryta处方信息。研究在45名年龄在4到12岁(不包括12岁)的SCD儿童患者中进行,以血红蛋白应答率为评价指标。给药第24周结果表明:基于体重计算儿童患者Oxbryta分散片剂使用剂量并给药治疗后,血红蛋白应答率为36%(16/45)(95% CI: 21.6%,49.5%),患者血红蛋白水平得到改善,同时也显示溶血及红细胞破坏也相应减少。
此前进行的三期临床研究采用随机、双盲和安慰剂对照设计。274名年龄在12岁至65岁SCD患者入组,以血红蛋白水平应答率为评价指标,按1:1:1随机给药1500mg、900mg及安慰剂,每日一次,旨在评价剂量组与安慰剂之间的SCD疗效及安全性。结果显示,在治疗的第24周,与安慰剂对比,1500mg药物组血红蛋白水平应答率(51.1%)显著高于安慰剂组(6.5%)(p<0.001)。在72周治疗期间,患者血红蛋白水平得到了迅速而持久的改善。
安全性方面:Oxbryta最常见的副作用包括腹泻,头痛(32%),腹泻(23%)腹痛(23%),皮疹或荨麻疹(15%),恶心呕吐(19%)以及发烧(15%)。4到12岁以下儿童患者中最常见的不良反应包括呕吐(33%)、皮疹(20%)、腹痛(18%)、腹泻(18%)和头痛(18%)。
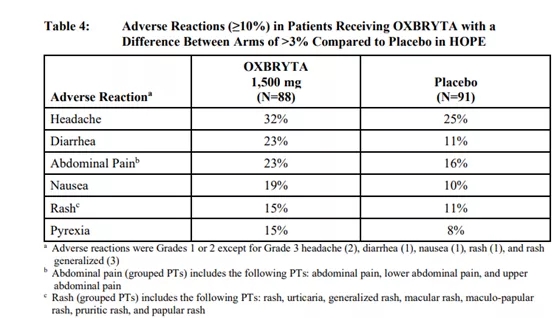
12岁及以上不良反应(图片来源:drugapprovalsint.com)

4到12岁不良反应汇总(图片来源:drugapprovalsint.com)
此前,FDA已授予Oxbryta孤儿药资格、治疗SCD的突破性药物资格(BTD)、快速通道地位以及罕见儿科疾病资格。
参考来源:
1.https://baike.baidu.com/item/%E9%95%B0%E7%8A%B6%E7%BB%86%E8%83%9E%E7%97%85/5690362?fr=aladdin
2.https://www.oxbryta.com/pdf/prescribing-information.pdf
3.U.S. FDA ApprovesSupplemental New Drug Application for Expanded Indication of Oxbryta®(voxelotor) for Children as Young as 4 Years of Age with Sickle Cell Disease |Global Blood Therapeutics, Inc. (gbt.com)