对纳入优先审评审批程序的临床急需的境外已上市境内未上市的罕见病药品,其上市申请审评时限为70日。
对国内没有批准上市的药品,如临床救治急需,医疗机构可以申请进口少量药品用于救治患者,由国家药监局或国务院授权的省政府批准(目前国务院已授权海南省、广东省)进口。进口氯巴占还应当取得国家药监局核发的精神药品进口准许证。
截至目前,已有8家企业按照有关规定获准研制氯巴占。国内尚未有企业提出氯巴占制剂的上市申请,但已有2家企业提交临床试验申请并获得临床批件。
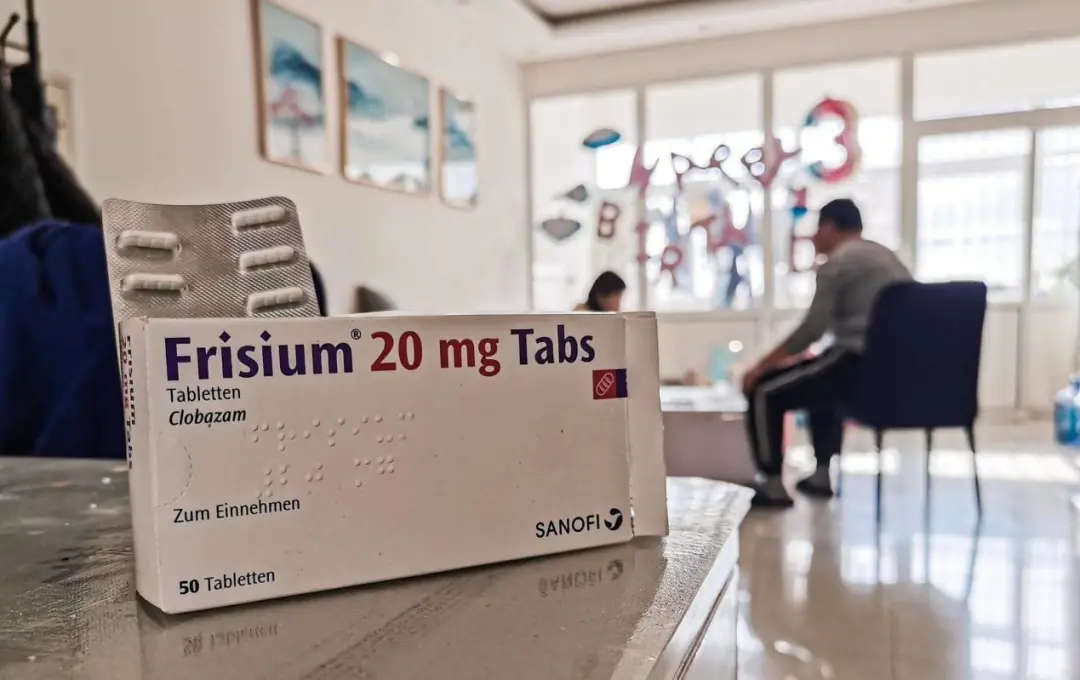
▲对国内没有批准上市的药品,如临床救治急需,医疗机构可以申请进口少量药品用于救治患者。 (齐鲁晚报·齐鲁壹点 李静、李岩松/图)
2021年12月9日,南方周末刊发《“贩毒”母亲获释背后:上千患儿用药告急,“救命药”何时特批?》一文,报道了国内数千儿童癫痫症患儿濒临断药,急需从境外购买“氯巴占”药物的故事。
而在患儿家长联名求助信发出之后,这些家庭的不幸遭遇也引发了社会各界的关注。针对罕见疾病药品(含氯巴占)的缺药问题,12月15日,国家药品监督管理局有关负责人回答了南方周末记者的提问。
1、尚无企业提出“氯巴占”上市申请
南方周末:临床急需药品是否有官方渠道来申请进口?相关的规定是什么?
国家药监局:为加强药品管理,保证药品质量,保障公众用药安全和合法权益,保护和促进公众健康,我国制定了《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》等一系列药品管理法律法规,对药品实施监督管理。根据药品管理法有关规定,药品可通过由药品持有企业在我国申报药品注册的方式,在我国上市。
药品管理法第二十四条规定,在中国境内上市的药品,应当经国务院药品监督管理部门批准,取得药品注册证书。申请药品注册,应当提供真实、充分、可靠的数据、资料和样品,证明药品的安全性、有效性和质量可控性。药品管理法第二十五条规定,对申请注册的药品,国务院药品监督管理部门应当组织药学、医学和其他技术人员进行审评,对药品的安全性、有效性和质量可控性以及申请人的质量管理、风险防控和责任赔偿等能力进行审查,符合条件的,颁发药品注册证书。
2015年以来,按照国务院部署,国家药监局对药品审评审批制度实施深化改革,通过建立临床试验默示许可制度,接受符合要求的境外临床试验数据,设立优先审评审批、附条件批准等工作制度,并以药品管理法、《药品注册管理办法》等法律法规予以制度化,鼓励具有临床价值的境外药品在我国上市,可由境外的药品上市许可持有人提出在中国境内上市的申请。目前,尚无药品企业向我局提出氯巴占片的药品注册上市申请。
2、纳入优先程序,上市申请审评时限为70日
南方周末:罕见病用药作为临床急需药品的一种情形,其申请流程是什么?用时需要多久?
国家药监局:根据药品管理法、《药品注册管理办法》的有关规定,申请人在申请药品上市注册前,应当开展药学、药理毒理学和药物临床试验等研究工作,证明药品的安全性、有效性和质量可控性。国家药监局药品审评中心按要求对已受理的药品上市许可申请进行审评,综合审评结论通过的,批准药品上市,发给药品注册证书,药品注册审评时限为200个工作日。
为鼓励罕见病药物的研制,药品管理法第九十六条规定,国家鼓励短缺药品的研制和生产,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批。《药品注册管理办法》及其配套文件规定,用于防治列入罕见病目录的疾病(国家卫生健康委员会等部门联合发布),具有明显临床价值的创新药和改良型新药,可纳入优先审评审批程序。对纳入优先审评审批程序的临床急需的境外已上市境内未上市的罕见病药品,其上市申请审评时限为70日。
3、进口少量药品,应由医疗机构提出申请
南方周末:根据药品管理法第六十五条规定,医疗机构因临床急需进口少量药品的,经国务院药品监督管理部门或者国务院授权的省、自治区、直辖市人民政府批准,可以进口。进口的药品应当在指定医疗机构内用于特定医疗目的。氯巴占是否适用药品管理法第六十五条规定?
国家药监局:对国内没有批准上市的药品,如临床救治急需,医疗机构可以按照药品管理法第六十五条规定,申请进口少量药品用于救治患者,由国家药监局或国务院授权的省政府批准(目前国务院已授权海南省、广东省)进口。为控制使用过程中的安全性有效性风险,应当由医疗机构提出申请,并负责药品的具体使用。
由于氯巴占具有一定的成瘾性,国际药物管制公约将其列入《1971年精神药物公约》进行管制。在我国氯巴占列入第二类精神药品管理。根据药品管理法第六十六条,进口氯巴占还应当取得国家药监局核发的精神药品进口准许证。
2017年发布的《第二批鼓励研发申报儿童药品建议清单》纳入了氯巴占,旨在鼓励研发,满足中国大陆境内尚未注册上市且临床急需的儿童药品。截至目前,已有8家企业按照有关规定获准研制氯巴占。
南方周末:目前氯巴占生产企业审评申报状况如何?有多少企业申报了氯巴占临床试验或注册上市申请?
国家药监局:截至目前,国内尚未有企业提出氯巴占制剂的上市申请。但已有2家企业提交临床试验申请并获得临床批件。
本文首发于南方周末
文|南方周末记者 崔慧莹