Spark Therapeutics是一家专注基因疗法的生物技术公司,于2019年被罗氏斥资43亿美元收购。11月18日,顶级期刊NEJM公布了Spark A型血友病候选基因疗法SPK-8011的Ⅰ/Ⅱ期临床试验结果,首次证明了 A型血友病患者接受基因治疗后凝血因子Ⅷ能够长期稳定表达[1]。

A型血友病的主要发病机制是凝血因子Ⅷ缺乏,是临床上最常见的血友病类型,约占总患病人数的80%-85%,全球每5000名男性中就有1人患该病。凝血因子Ⅷ缺乏会导致无法控制的出血、致残性关节疾病并增加死亡风险。目前的治疗手段包括定期输注因子Ⅷ(FVIII)蛋白以替代缺失的凝血因子,但这类疗法不能改善患者的关节疾病,也不会降低死亡风险。

SPK-8011是一种新型重组腺病毒相关(AAV)载体,旨在宿主肝细胞中产生FVIII,该疗法已获FDA授予的孤儿药和突破性疗法资格。
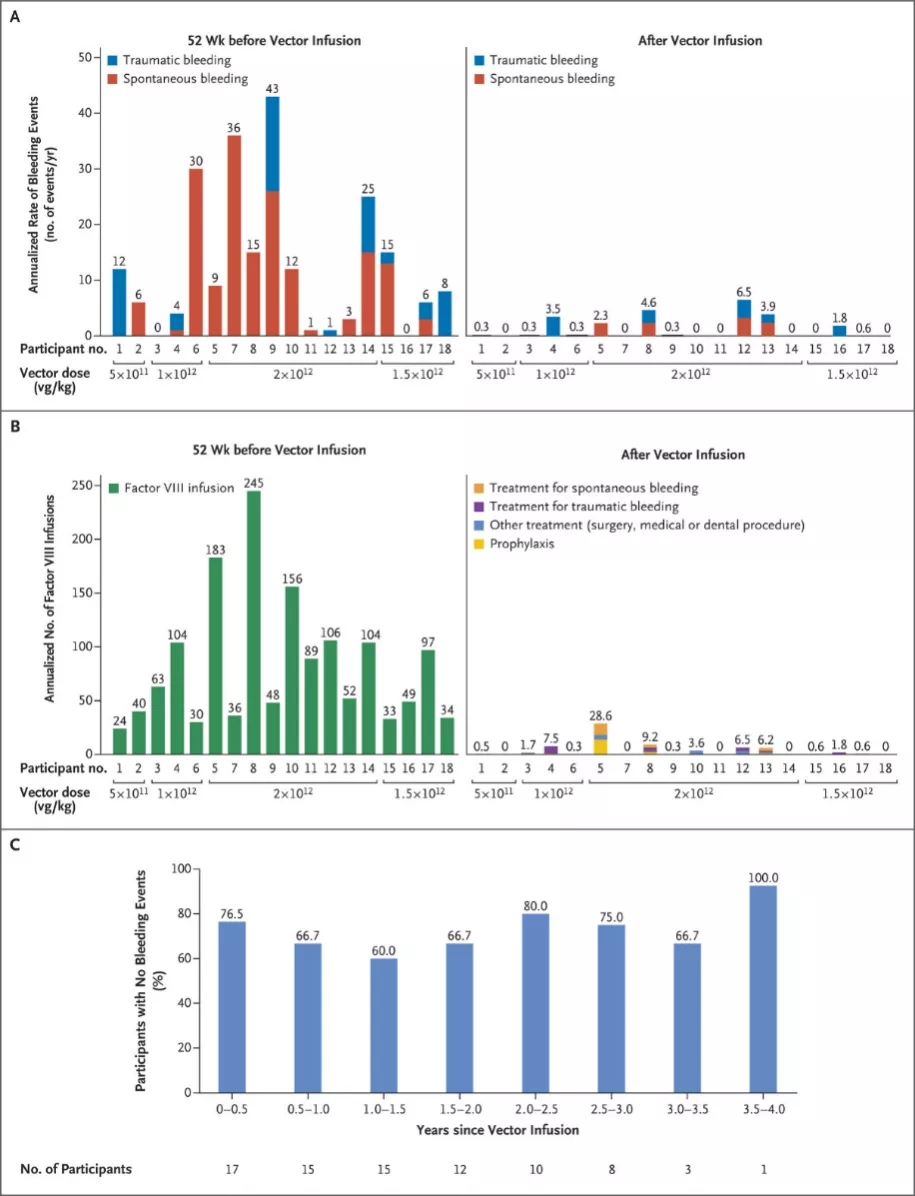
在这项多中心试验中,研究人员向18例A型血友病男性患者输注了SPK-8011。该试验分为4个剂量组,并对入组患者进行了长达4年的FVIII表达、安全性和初步疗效随访。临床数据显示,18例患者没有出现重大安全问题,16例受试者在临床试验期间肝脏均能表达FVIII。其中12例受试者接受了两年以上的随访,并未发现FVIII的表达量随着时间的推移而显著降低。总的来说,参与试验的男性受试者出血事件减少了91.5%。但18例受试者中也发现了2例在给药1年后不表达FVIII,表明试验中采用的类固醇不能完全防止AAV的预存免疫现象。
SPK-8011初步疗效分析(来源:NEJM)
该临床试验表明,SPK-8011可实现A型血友病患者FVIII的持续表达,并使患者的出血风险降低了90%以上。该项临床研究的主要领导人、费城儿童医院血液科主任Lindsey A. George博士表示该临床数据支持了之前的假设,即靶向肝脏的AAV基因疗法是治疗A型血友病长效可行的治疗方法。该方法还将在未来进一步改进,以安全地在所有这类患者中实现持续、稳定和可预测的FVIII水平。 据医药魔方NextPharma数据库,目前SPK-8011在A型血友病领域的主要竞争对手是BioMarin的Valrox和辉瑞/Sangamo的SB-525。Valrox目前已重新向欧洲药品管理局(EMA)递交上市申请,而SB-525已进入Ⅲ期临床。国内方面,至善唯新、本导基因等也布局了治疗A型血友病的基因疗法项目,目前均处于临床前研发阶段。

专家点评
至善唯新 董事长 董飚
董飚博士,四川至善唯新生物科技有限公司董事长兼总经理,四川大学生物治疗国家重点实验室研究员,华西医院国家老年疾病临床医学研究中心研究员。AAV基因药物开发国际专家,现任美国细胞和基因治疗学会两个专委会委员。其研究的疾病包括遗传病(如A型和B型血友病)以及后天性疾病(如帕金森症和老年痴呆)等。研究成果包括∶1)解决了rAAV基因药物药物设计中治疗基因的包装容量这一关键问题;2)发明了新型rAAV生产系统,打破了大规模化生产的瓶颈,增强了载体的安全有效性;3)发明了高活力的治疗A型血友病的FVII因子(PCT专利授权)和B型血友病的IX因子(中国专利申请),为血友病的基因治疗奠定了坚实的基础。
Spark Therapeutics发表在NEJM上的这项研究进展取得了怎么样的突破?
董飚:Spark的研究使用的AAV载体由三质粒共转染293细胞制备。载体使用的AAV血清型为改造的AAV3,VIII因子表达框架由肝脏特异启动子TTR驱动密码子优化后的FVIII-SQ,表达框架长度为5066bp。治疗方案的载体剂量分别为5x1011vg/Kg、1.0x1012vg/Kg、1.5x1012vg/Kg和2.0x1012vg/Kg,其中最高剂量是目标剂量。研究结果显示,在使用该AAV载体治疗A型血友病时,18例入组患者中的16例获得成功,在1-4年中体内能稳定表达12.0±7.1%的凝血因子Ⅷ,不再需要定期输入外源VIII因子,表明利用AAV载体治疗A型血友病可以让VIII因子长期稳定表达,这是该研究的一个重大突破。在BioMarin进行的类似研究中(NCT02576795;采用杆状病毒感染昆虫细胞的方法制备AAV5血清型的载体,使用肝脏特异启动子HLP驱动密码子优化后的的VIII-SQ,表达框架为4951bp),VIII因子在长期表达过程中持续下降[2-3]。
该研究的另外一个突破是成功实现了治疗基因的异位稳定表达。VIII因子在正常情况下是在内皮细胞而不是肝脏细胞中产生。这和成功利用IX因子治疗B型血友病的AAV基因治疗是一个根本的不同。IX因子原本就是在肝脏细胞中产生和分泌的。最后,该研究还证明了在A型血友病患者中维持10%以上的VIII因子水平可以极大地改善年出血率,从而提高生活质量,这为后面类似的研究提供了一个参考的临床指标。
总体来说,这次Spark公司的研究为利用AAV载体治疗A血友病的长期治愈铺平了道路;同时也为利用肝脏作为生物反应器,异位表达分泌型治疗基因的针对其它遗传病的AAV基因疗法带来了希望。
不过,该研究在针对AAV衣壳出现的细胞免疫的治疗方案上还有继续改进的空间。该研究方案中,糖皮质激素是在患者出现细胞免疫或治疗后的2-4周使用。由于2例使用高剂量的患者对糖皮质激素的治疗不敏感,最终导致了治疗的失败。因此,使用更适合的免疫抑制药物及处理时间(比如在治疗前使用糖皮质激素)或使用新血清型是未来的研究方向。另外,治疗后患者体内的VIII因子的表达水平为12%左右,在后续更长期的跟踪研究中可能会看到表达水平下降到10%以下。因此,使用活力加强的VIII因子可以在相同治疗条件下增加VIII的活力,这对达到长期治愈的目标将是非常有益的。
与A型血友病的现有疗法相比,基因疗法有何优势?
董飚:A型血友病的现有疗法主要是替代疗法,即给患者注射重组VIII因子蛋白或血浆来源的VIII因子。西方发达国家的患者主要使用重组蛋白进行预防性治疗,每星期2-3次,费用在23万美元/年左右。针对中度(1%-5%)或轻型(5%-40%)的患者,现在还可以使用每月皮下注射一次双特异性抗体Hemlibra,费用为45万美元/年左右。我国主要为按需治疗,大部分患者使用价格相对便宜的血浆来源的Ⅷ因子。但在长期使用替代疗法的患者中,30%会出现VIII因子抗体从而导致治疗无效,最后不得不使用更加昂贵的重组VIIa因子或Hemlibra进行治疗。
基因治疗,特别是利用AAV载体表达VIII因子的基因治疗,可以实现“一次治疗,长期治愈”的效果。同时,在已获得4年治疗后的患者中未发现VIII因子抗体的产生。由于AAV载体是目前最为安全的病毒载体并在临床试验中显示了很好的有效性,利用其开展的基因治疗是目前最受期待的治疗方式。
基于AAV载体的基因疗法距离真正的大规模临床应用,目前还有哪些障碍需要克服?如何克服?
董飚:根据现有的Spark和BioMarin的两个相关临床试验长期随访的结果来看,基于AAV载体治疗A型血友病的基因疗法距离真正的大规模临床应用还需要克服下面几个难题:(1)AAV衣壳的细胞免疫。这个主要体现在两个方面,一个是免疫抑制药物的选择和使用时间,二是血清型的选择。(2)长期安全性的评估。基因治疗是一种新型疗法,成功的治疗案例和病人更长期的追踪数据相对不足,鉴于AAV载体的特性,需要更多的数据和更好的创新性的评估方法。(3)药物设计的优化。在生产过程中尽量减少副产品的含量,提高治疗的有效性和安全性。
至善唯新目前搭建了怎样的基因治疗管线?相比竞争对手有何技术优势?
董飚:至善唯新目前搭建了包括A型和B型血友病、代谢性疾病和神经系统疾病的多条基因治疗管线。公司专注于AAV基因药物设计和生产的平台技术建设。为此,我们建立了启动子筛选、治疗基因的基因工程强化、密码子优化和衣壳筛选等全面覆盖药物设计的技术平台;我们还建立了成熟的三质粒转染200L悬浮293系统,并拥有能更大规模生产AAV载体并极大降低生产成本的痘-腺病毒系统。 就A型血友病的治疗而言,我们使用自己开发的小型、高效的肝脏启动子和通过基因工程获得的高活力VIII因子(3个氨基酸突变,gainof function),在进一步提高疗效的同时还可以保证AAV载体的包装完整性。我们使用的载体全长为4817bp,低于Spark和BioMarin的5kb左右的载体长度。虽然AAV的有效包装的极限长度是5kb,但在这个长度下,包装不完整的治疗基因的载体所占比例高,会一定程度影响疗效。因此,我们在AAV基因药物的原创性研发和生产上有很好的优势。
除了血友病,近期还有哪些疾病的基因疗法开发取得了重要进展?
董飚:近期,AAV基因治疗在杜氏肌营养不良症(DMD)的治疗上,Pfizer和Sarepta都取得了重要进展,分别进入了III期临床试验。另外,Voyager在今年的ASGCT年会上报道了比AAV9对神经系统感染提高1000倍以上的血清型,这对神经系统疾病的基因治疗奠定了很好的基础。在老年黄斑病变的AAV基因治疗上,Regeneron取得了良好效果,进入了III期临床试验。在地中海贫血的基因治疗上,利用基因编辑的方法改造造血干细胞,国内外都有成功的早期临床试验报告。
未来3-5年,基因治疗领域预计会取得哪些突破?
董飚:基因治疗为现阶段无有效治疗手段的疾病(如遗传病和神经退行性疾病等)提供了新的治疗方案,是生物医药的前沿技术。目前利用病毒载体的基因疗法在遗传病的治疗上取得了非常好的效果,未来几年,病毒载体的靶向性有望进一步提升;此外,随着大量相关新药进入临床前评估和临床试验,未来3-5年内,基因治疗可能会在非病毒载体的使用(通过化学合成,获得靶向细胞种类更多、效率更高的非病毒载体)及针对后天性疾病如感染性疾病上取得突破。
参考资料:[1] LindseyA. George et al. Multiyear Factor VIII Expression after AAV Gene Transfer for Hemophilia A. NEJM(2021).
[2] RangarajanS, Walsh L, Lester W, et al. AAV5–factor VIII gene transfer in severe hemophilia A. N Engl J Med 2017;377:2519-2530.
[3] Pasi KJ,Rangarajan S, Mitchell N, et al. Multiyear follow-up of AAV5-hFVIII-SQ genetherapy for hemophilia A. N Engl J Med 2020;382:29-40.