11月18日,CDE官网显示,勃林格殷格翰IL-36R单抗司柏索利单抗注射液(Spesolimab,BI655130)上市申请已获国家药监局受理。用于治疗泛发性脓疱型银屑病(GPP)。
泛发性脓疱型银屑病(GPP) 是一种较为少见的银屑病的亚型。其特征是反复发作泛发性的脓疱,常伴有高热,严重时可危及生命,治疗较为困难,目前缺乏统一的治疗方案。Spesolimab是一种新型人源化选择性抗体,可阻断白介素 36受体 (IL-36R) 的激活,IL-36R是免疫系统内的一种信号通路,已被证明与包括GPP在内的多种自身免疫性疾病的发病有关。
一项代号为Effisayil 1的全球性、II期、多中心、随机、双盲、安慰剂对照试验评估了Spesolimab在急性发作的泛发性脓疱性银屑病患者中的有效性、安全性和耐受性。
至少51例急性发作的GPP患者按2:1随机分组,分别接受单剂900mg spesolimab静脉注射(如果症状持续到第8天,可选择第2剂)或安慰剂治疗,随访长达28周。研究结果显示,治疗1周后,spesolimab组患者脓疱清除效果显著优于安慰剂。
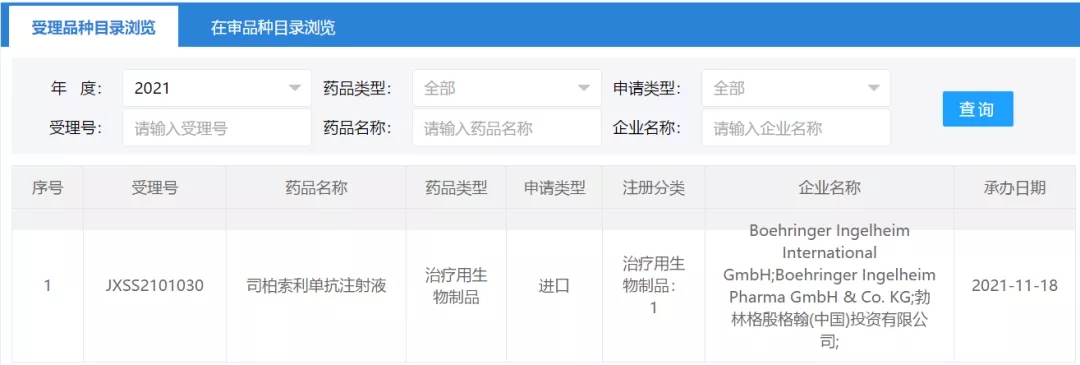
此外,2019年3月发表在新英格兰医学杂志上的一篇文献报道了BI655130治疗GPP患者的 I 期概念性验证临床研究结果。治疗1周,5例患者GPPGA(泛发性脓疱性银屑病医师总体评估)评分变为0或1(清除或几乎完全清除),到第4周,所有患者(有或没有IL36RN突变)GPPGA评分均变为0或1。
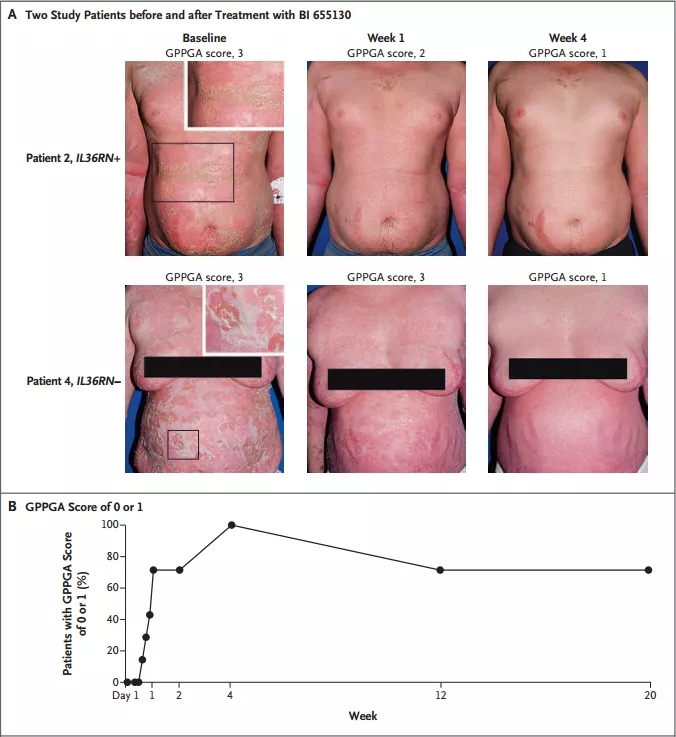
安全性方面,所有患者均出现轻度或中度不良事件,无严重不良事件发生,其中有4例患者出现药物相关不良事件。
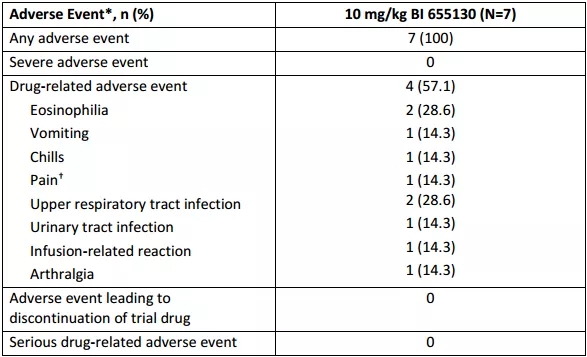
今年6月,Spesolimab获CDE突破性疗法认定,用于治疗泛发性脓疱型银屑病。
值得注意的是,勃林格殷格翰已于今年10月29日向欧洲药监局递交了Spesolimab用于泛发性脓疱性银屑病的上市许可申请。