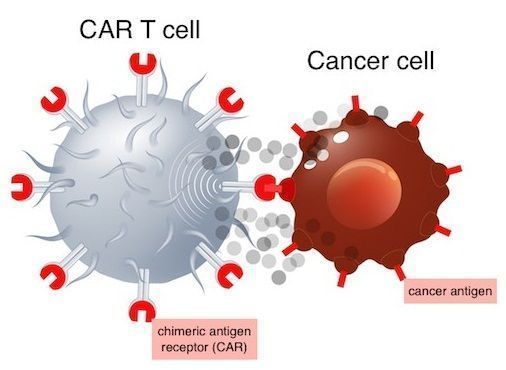
CAR-T细胞疗法(图片来源:childrenshospital.org)
诺华(Novartis)近日宣布,美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)已分别受理CD19 CAR-T细胞疗法Kymriah(tisagenlecleucel)的补充生物制品许可申请(sBLA)和II类变更:用于治疗先前接受过至少2种疗法的复发或难治性滤泡性淋巴瘤(r/r FL)成人患者。FDA已授予该sBLA优先审查。
此前,FDA已授予Kymriah治疗r/r FL的再生医学先进疗法(RMAT)资格;欧盟委员会(EC)已授予Kymriah治疗FL的孤儿药资格(ODD)。如果获批,Kymriah将为r/r FL患者提供一个重要的治疗选择。同时,r/r FL也将成为Kymriah的第三个B细胞恶性肿瘤适应症。
Kymriah是一种CD19导向的基因修饰自体T细胞免疫细胞疗法。与常规的小分子或生物疗法不同,CAR-T细胞疗法是一种活的T细胞治疗产品。Kymriah的原理是将患者的T细胞进行基因修饰表达一种旨在靶向抗原CD19的嵌合抗原受体(CAR),CD19是一种表达于多种血液肿瘤细胞表面的抗原蛋白,包括B细胞淋巴瘤和白血病细胞。
Kymriah是美国FDA批准的第一个CAR-T细胞疗法,目前在全球30个国家上市,有超过345个认证的治疗中心。Kymriah是一种一次性治疗方法,旨在增强患者的免疫系统来对抗癌症。目前,Kymriah被批准的适应症包括:(1)治疗复发或难治性急性淋巴细胞白血病(r/r ALL)儿童和年轻成人患者(年龄至25岁);(2)治疗复发或难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者。
此次新适应症申请,基于关键2期ELARA试验的阳性数据。这是一项单臂、多中心、开放标签2期试验,评估了Kymriah治疗R/R FL成人患者的疗效和安全性。数据显示,该研究在先前接受过多种疗法(中位数:4种[范围:2-13种])的r/r FL患者中观察到了强劲的缓解率:完全缓解率(CR)达66%、总缓解率(ORR)达86%。安全性非常显著,在输液后的前8周内,没有患者出现与Kymriah相关的3级或更高级别的细胞因子释放综合征(CRS)。该试验的数据于今年早些时候在2021年美国临床肿瘤学会(ASCO)年会虚拟会议上公布。
诺华执行副总裁兼肿瘤和血液学开发全球主管Jeff Legos表示:“这是我们为复发或难治性滤泡性淋巴瘤成人患者提供Kymriah的任务中的一个重要里程碑。从EC获得孤儿药物资格以及FDA的优先审查,强调了这些患者中尚未满足的显著需求和紧迫性。Kymriah在ELARA试验中展示了令人印象深刻的结果,我们我们希望我们能够提供一种独特且潜在的最终治疗方法,从而将负担降至最低。”
原文出处:Novartis receives priority review by US FDA and filing acceptance by EMA for Kymriah® to treat patients with relapsed or refractory follicular lymphoma