今日,中国国家药监局(NMPA)公示显示,强生(Johnson & Johnson)旗下杨森公司(Janssen)的CD38单抗达雷妥尤单抗注射液(皮下注射)上市申请已在中国获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,该申请针对适应症为:治疗原发性轻链型淀粉样变患者。公开资料显示,达雷妥尤单抗皮下注射剂型可以在大约3到5分钟内给药,与该产品静脉注射剂相比,能够将患者的给药时间从几小时缩短到几分钟。
在中国,原发性轻链型淀粉样变已被纳入《第一批罕见病目录》。这是一种罕见的危及生命的疾病。它发生在骨髓中的浆细胞产生异常的轻链时,这些异常的轻链形成了淀粉样蛋白沉积物并在重要器官中积累,最终导致器官退化。该疾病可影响不同人群的多种器官,最常见的器官是心脏、肾脏、肝脏、脾脏、胃肠道和神经系统。目前,这类患者急需新的治疗选择。
公开资料显示,杨森公司的达雷妥尤单抗是全球及中国首个获批的靶向作用于CD38的全人源单克隆抗体,此前已在中国获批静脉注射剂型,用于治疗多发性骨髓瘤患者。
研究显示,达雷妥尤单抗能够以高亲和力的方式,特异性识别在多发性骨髓瘤恶性浆细胞上高表达的CD38,进而通过多种免疫介导机制来诱导肿瘤细胞的死亡。虽然免疫球蛋白轻链型淀粉样变性与多发性骨髓瘤的发病机理截然不同,但是过度生成免疫球蛋白轻链的浆细胞同样表达CD38,因此可以使用达雷妥尤单抗靶向清除。

达雷妥尤单抗皮下注射剂(英文商品名:Darzalex Faspro)是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方。rHuPH20是Halozyme Therapeutics公司基于Enhanze药物递送技术而开发,它可以降解体内的透明质酸,以帮助皮下注射药物的渗透和吸收。此前,达雷妥尤单抗皮下注射剂已在美国获FDA批准治疗多发性骨髓瘤、轻链(AL)淀粉样变性等适应症。
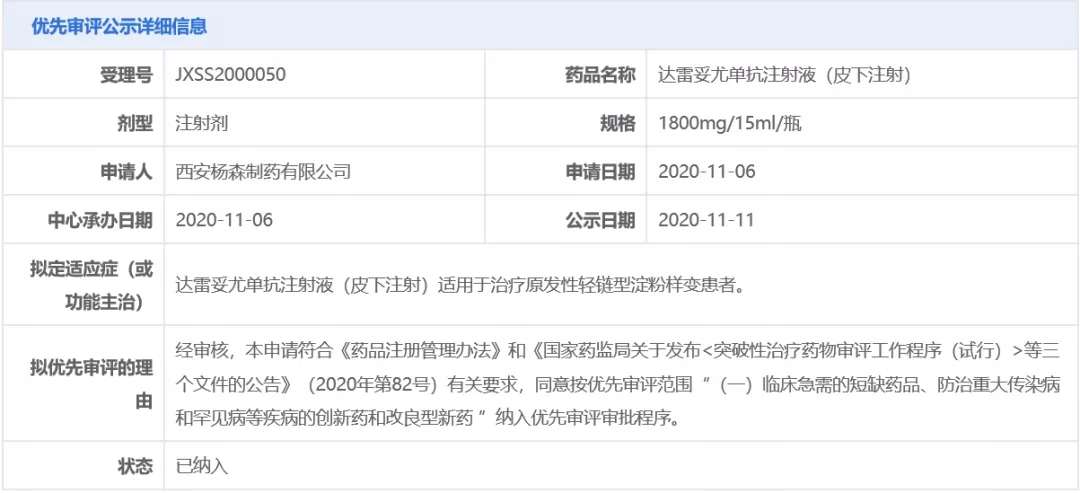
2020年11月,杨森公司在中国递交达雷妥尤单抗注射液(皮下注射)的上市申请。该申请随后被CDE以“临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”为由纳入优先审评,拟用于治疗原发性轻链型淀粉样变患者。
根据一项名为ANDROMEDA的3期研究数据,该研究评估了达雷妥尤单抗注射液(皮下注射)联合硼替佐米、环磷酰胺和地塞米松(VCd方案),与单独使用VCd方案相比的疗效和安全性。结果显示,接受达雷妥尤单抗注射液(皮下注射)联合治疗的患者,血液学完全缓解率(hemCR)是单独接受VCd方案治疗患者的三倍以上(42% vs 13%)。
此次达雷妥尤单抗注射液(皮下注射)在中国获批,意味着它将惠及更多轻链型淀粉样变患者,希望它的到来能让更多中国患者获益。
参考资料:
[1]2021年10月11日药品批准证明文件待领取信息发布 . Retrieved Oct 11,2021, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20211011140106162.html
[2] U.S. Food and Drug Administration Approves DARZALEX FASPRO™ (daratumumab and hyaluronidase-fihj), a New Subcutaneous Formulation of Daratumumab in the Treatment of Patients with Multiple Myeloma. Retrieved 2020-05-04, from https://www.janssen.com/us-food-and-drug-administration-approves-darzalex-fasprotm-daratumumab-and-hyaluronidase-fihj-new
[3] Genmab Announces Positive Topline Results in Phase III ANDROMEDA Study of Daratumumab in Light-chain (AL) Amyloidosis. Retrieved 2020-05-29, from http://www.globenewswire.com/news-release/2020/05/28/2040461/0/en/Genmab-Announces-Positive-Topline-Results-in-Phase-III-ANDROMEDA-Study-of-Daratumumab-in-Light-chain-AL-Amyloidosis.html
[4] DARZALEX FASPRO® (daratumumab and hyaluronidase-fihj) Becomes the First FDA-Approved Treatment for Patients with Newly Diagnosed Light Chain (AL) Amyloidosis. Retrieved Jan 15, 2021, from https://www.janssen.com/darzalex-faspror-daratumumab-and-hyaluronidase-fihj-becomes-first-fda-approved-treatment-patients
版权声明:本网站所有注明“来源:罕见病信息网”的文字、图片和音视频资料,版权均属于罕见病信息网网站所有。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。