药明康德内容团队编辑
2021年8月6日,美国FDA宣布批准赛诺菲(Sanofi)的酶替代疗法(ERT)Nexviazyme(avalglucosidaseα-ngpt)上市,用于治疗1岁及以上的晚发性庞贝病(late-onset Pompe disease,LOPD)患者。庞贝病是一种进行性、使人衰弱的肌肉疾病,会损害人的行动和呼吸功能。Nexviazyme能够特异性靶向细胞摄取的关键途径甘露糖-6-磷酸(M6P)受体。此前, Nexviazyme已获得FDA授予治疗庞贝病的突破性疗法认定和快速通道资格。

庞贝病是由溶酶体中的酸性α-葡萄糖苷酶(GAA)的遗传缺陷或功能障碍引起的。GAA会导致全身肌肉细胞中糖原的积累,从而导致不同肌肉不可逆的损伤,包括支持呼吸功能的膈肌和影响人体活动、功能耐力和呼吸的骨骼肌。
而将GAA酶转运到细胞内溶酶体的关键途径就是M6P受体。与标准治疗α-葡萄糖苷酶相比,Nexviazyme的M6P含量增加约15倍,旨在帮助改善细胞对酶的摄取并增强目标糖原清除。
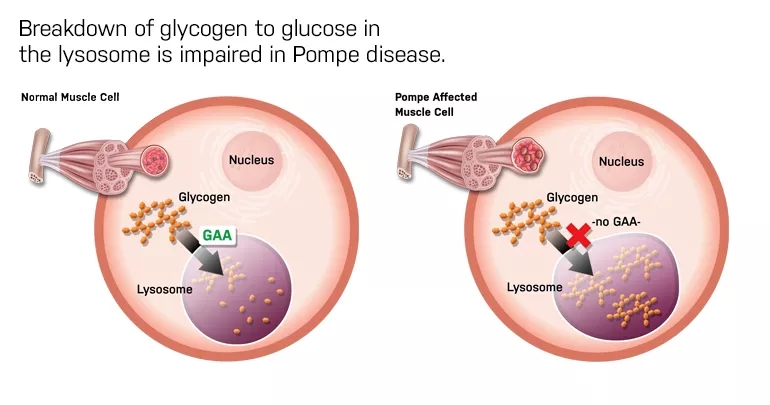
▲庞贝病患者的糖原降解出现缺陷(图片来源:pompe.com)
本次批准是基于关键性3期临床试验COMET获得的积极结果,试验数据证明,Nexviazyme可以为患者提供步行距离和呼吸功能指标的改善。具体主要结果如下所示:
第49周时,试验达到改善呼吸功能的主要终点。即与基线相比,Nexviazyme组的用力肺活量预测值百分比(FVC percent predicted)改善2.9分(SE=0.9)。与对照组相比,Nexviazyme组的FVC预测值百分比改善2.4分,达到非劣效性标准(p=0.0074;95% CI,-0.13,4.99),但未达到统计学优效性(p=0.06)。
在通过6分钟步行测试(6MWT)测量患者功能耐力与活动能力的关键次要终点上,第49周时,与基线相比,Nexviazyme组步行距离为32.2米(SE=9.9,95% CI,1.33,58.69),比活性对照组远30米。
安全性上,在49周的双盲活性对照期间,2例(2%)Nexviazyme组患者和3例(6%)对照组患者报告了严重不良反应。Nexviazyme组最经常报告的不良反应(>5%)是头痛,瘙痒,恶心,荨麻疹和疲劳。13例(25%)Nexviazyme组患者和16例(33%)对照组患者报告了输注相关反应。多例Nexviazyme组报告的输注相关反应为轻度至中度,包括头痛、腹泻、瘙痒、荨麻疹和皮疹。无重度输注相关反应。
“庞贝病是一种使人衰弱的进行性疾病,会显著抑制患者的行动能力和呼吸功能。”赛诺菲健赞(Sanofi Genzyme)副总裁Bill Sibold先生表示,“几十年来,我们一直致力于研究如何靶向M6P受体,这是酶替代疗法细胞摄取的关键途径。临床试验表明,对晚发型庞贝病患者而言,Nexviazyme是一种潜在的新标准治疗,这也同时实现了我们为罕见病患者带来新疗法的承诺。”
参考资料:
[1] FDA approves Nexviazyme® (avalglucosidase alfa-ngpt), an important new treatment option for late-onset Pompe disease. Retrieved August 6, 2021, from https://www.globenewswire.com/news-release/2021/08/06/2276588/0/en/FDA-approves-Nexviazyme-avalglucosidase-alfa-ngpt-an-important-new-treatment-option-for-late-onset-Pompe-disease.html
[2] FDA Approves New Treatment for Pompe Disease. Retrieved August 6, 2021, from https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-pompe-disease
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。