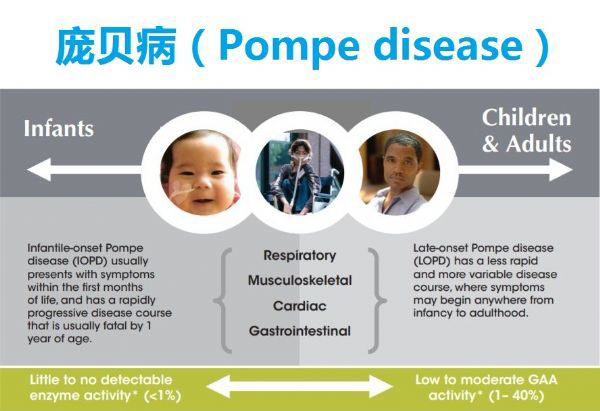
庞贝病谱系(图片来源:sanofigenzymemedicalaffairs.com)
2021年07月26日讯 /生物谷BIOON/ --根据欧洲药品管理局(EMA)网站最新信息,该机构人用药品委员会(CHMP)已发布一份积极审查意见,建议批准赛诺菲(Sanofi)旗下罕见病单元赛诺菲健赞(Sanofi Genzyme)开发的第二代酶替代疗法Nexviadyme(avalglucosidase alfa,neoGAA),用于庞贝病(Pompe disease)患者的长期酶替代治疗。
现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计在未来2个月内做出最终审查决定。Nexviadyme也正在接受美国FDA的审查。之前,FDA授予了Nexviadyme治疗庞贝病的突破性药物资格(BTD)和快速通道资格(FTD),并通过优先审查程序对Nexviadyme生物制品许可申请(BLA)进行审查。但在今年5月,FDA将BLA审查时间表推迟3个月,新的《处方药用户收费法》(PDUFA)目标日期为2021年8月18日。
目前,Lumizyme/Myozyme(alglucosidase alfa,重组阿葡糖苷酶α)是唯一被批准治疗庞贝病的酶替代疗法(ERT),该药也是由赛诺菲健赞开发,是治疗庞贝病的第一代ERT。Lumizyme/Myozyme是一种重组的酸性α-葡萄糖苷酶(GAA),这种酶在庞贝病患者中缺失。GAA是防止糖原在肌肉细胞中集聚到毒性水平的关键。Lumizyme/Myozyme旨在取代有缺陷的GAA,降低糖原在心脏和骨骼肌中的积累。
Nexviadyme是赛诺菲健赞开发的第二代ERT,这是一种长效ERT,该药物的开发旨在改善GAA向肌肉细胞的传递,将更多GAA递送至肌肉细胞的溶酶体中。如果获得批准,Nexviadyme将为庞贝病患者提供一种新的护理标准。在临床试验中,Nexviadyme治疗使庞贝病患者的呼吸功能和活动性方面表现出有临床意义的改善。

第一代ERT(alglucosidase alfa)与第二代ERT(avalglucosidase alfa):结构差异
Nexviadyme的监管申请基于2项临床试验(3期COMET研究、2期mini-COMET研究)的阳性数据。COMET(NCT02782741)是一项头对头3期研究,在晚发型庞贝病(LOPD)患者中开展。研究中,患者随机分配,接受Nexviadyme或标准护理药物Lumizyme治疗,剂量均为20mg/kg,每2周静脉输注一次。数据显示,治疗近一年(49周)期间,Nexviadyme使LOPD关键表现(呼吸障碍和活动能力下降)显示出临床意义的改善,并且疗效非劣效于Lumizyme。在该试验的开放标签部分,20例由Lumizyme转为Nexviadyme治疗的患者的初步数据也显示,在第97周时肺功能和活动性表现更好。
mini-COMET(NCT03019406)研究评估了Nexviadyme治疗婴儿型庞贝病(IOPD)的安全性和探索性疗效。所有患者都曾接受过Lumizyme治疗,但未能充分缓解。研究中,这些患者被随机分配至2种剂量(20mg或40mg/kg体重)Nexviadyme治疗,或接受其目前稳定剂量的Lumizyme。6个月数据显示,2种剂量Nexviadyme耐受性良好,无严重副作用。接受Nexviadyme治疗的患者也有较低或稳定水平的疾病生物标志物肌酸激酶和葡萄糖四糖。
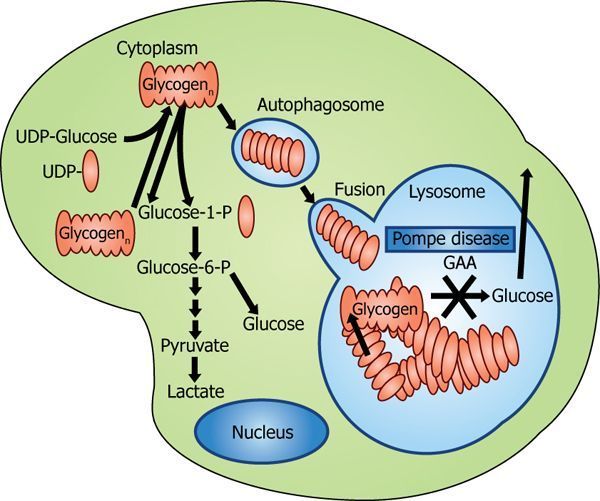
庞贝病通路(图片来源:foodnhealth.org)
庞贝病(Pompe disease)是由于遗传缺陷或溶酶体酶酸性α-葡萄糖苷酶(GAA)功能紊乱引起的,导致肌肉(包括近端肌肉和膈肌)糖原积聚,最终导致进行性和不可逆的肌肉损伤。这种罕见病影响到全世界大约50000人,从婴儿到成年晚期,它可以在任何年龄表现出来。庞贝病通常分为晚发型庞贝病(LOPD)或婴儿期庞贝病(IOPD)。LOPD患者通常在出生后的第一年到成年晚期出现。LOPD的特征性症状是呼吸功能受损和骨骼肌无力,常导致运动能力受损。患者通常需要轮椅来帮助移动,也可能需要机械通气来帮助呼吸。呼吸衰竭是庞贝病患者最常见的死亡原因。庞贝病被归类为IOPD时,症状在一岁前开始出现。除了骨骼肌无力外,心脏功能也普遍受到影响。
庞贝病酶替代疗法(ERT)的目的是将酶(GAA)导入肌肉细胞内的溶酶体,以取代缺失或缺乏的GAA,GAA是防止肌肉中糖原积聚所必需的一种酶。avaloglucosidase alfa是一种在研的庞贝病ERT,旨在改善酶向肌肉细胞的传递,尤其是向骨骼肌的传递。与标准护理药物alglucosidase alfa(阿葡糖苷酶α)相比,avaloglucosidase alfa的甘露糖-6-磷酸(M6P)含量增加了约15倍,目的是帮助提高细胞酶的吸收和靶组织中糖原的清除。这种差异的临床相关性尚未得到证实。
Lumizyme(阿葡糖苷酶α)是赛诺菲开发的第一代ERT,已被批准用于治疗庞贝病。avaloglucosidase alfa是第二代阿葡糖苷酶α(alglucosidase alfa)ERT,被专门设计为通过对肌肉细胞上M6P受体更大的亲和力,来增强受体靶向性和酶吸收,来增强糖原清除并提高阿葡糖苷酶α的临床疗效。临床前研究中,在降低组织糖原方面,avaloglucosidase alfa表现出约阿葡糖苷酶α 5倍的功效。在庞贝氏症小鼠模型中,avaloglucosidase alfa在五分之一剂量阿葡糖苷酶α时,即表现出相似的底物降低水平。(生物谷Bioon.com)
原文出处:EMA committee recommends Sanofi Genzyme Pompe treatment Nexviadyme