根据国家药品监督管理局(NMPA)网站公开信息显示,该机构已通过优先审评审批程序批准复星凯特生物科技有限公司(FOSUN Kite)申报的阿基仑赛注射液 (商品名:奕凯达)上市。该药品为我国首个批准上市的细胞治疗类产品,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)。
阿基仑赛注射液(奕凯达)是一种自体免疫细胞注射剂,由携带CD19 CAR基因的逆转录病毒载体进行基因修饰的自体靶向人CD19嵌合抗原受体T细胞(CAR-T)制备。该品种的上市为既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者提供了新的治疗选择。
复星凯特生物科技有限公司(以下简称:复星凯特)为复星医药集团与吉利德科学公司控股子公司美国Kite Pharma(凯特制药)的合营企业,2017年4月于中国上海注册成立。
阿基仑赛注射液(奕凯达,产品代号FKC876)是根据Kite Pharma的抗人CD19 CAR-T细胞注射液Yescarta(Axicabtagene Ciloleucel,Axi-Cel)经技术转移并拟在中国境内(不包括港澳台)进行本地化生产。该产品由复星凯特从Kite Pharma引进、获得在中国大陆、香港特别行政区和澳门特别行政区的技术及商业化权利。
2020年3月中旬,复星凯特宣布,国家药品监督管理局(NMPA)药品审评中心(CDE)将CAR-T细胞治疗产品阿基仑赛注射液(奕凯达)的新药上市申请(NDA)纳入优先审评。该产品是复星凯特在中国推进商业化的第一个CAR-T细胞治疗产品,也是国家药品监督管理局(NMPA)正式批准上市的第一个CAR-T细胞治疗产品。作为一种全新的肿瘤治疗手段,阿基仑赛注射液(奕凯达)能够为中国接受了二线或以上系统性治疗后复发或难治的大B细胞淋巴瘤患者带来新生的希望和机会。
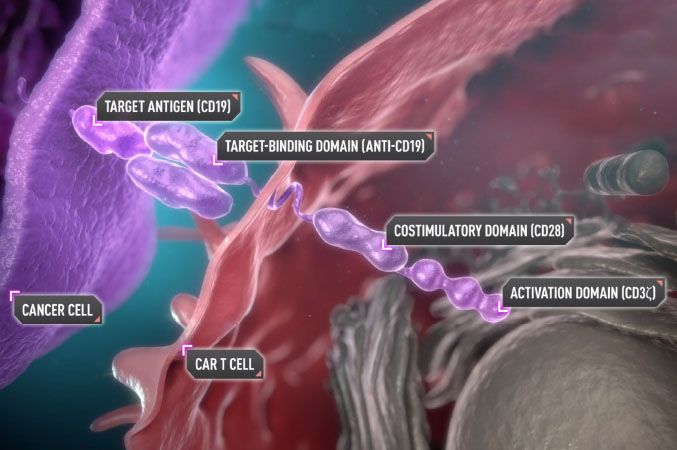
Yescarta作用机制(图片来源:yescartahcp.com)
根据复星凯特网站信息,淋巴瘤是起源于淋巴结和/或结外淋巴组织的一组异质性肿瘤,主要分为霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)两大类,后者更为多见。弥漫大B细胞淋巴瘤(DLBCL)是成人淋巴瘤中最常见的一种NHL,并且属于临床表现和预后等多方面具有很大异质性的恶性肿瘤,其发病率占NHL的31%~34%,在亚洲国家一般高于40%。
我国2011年一项由24个中心联合进行、共收集10002例病例样本的分析报告指出,在中国,DLBCL占所有NHL的45.8%,占所有淋巴瘤的40.1%。有数据显示,2018年中国新发NHL病人88090例。国外文献报道,有20%-50%的DLBCL患者一线治疗后被评估为难治或复发。
Yescarta是一款靶向CD19自体CAR-T细胞治疗产品,于2017年10月获美国FDA批准,是第一个治疗复发或难治性大B细胞淋巴瘤(LBLC)成人患者的CAR-T细胞疗法。Yescarta注册临床研究ZUMA-1长期随访数据显示,接受Yescarta治疗的复发难治性大B细胞淋巴瘤(r/r LBCL)患者中总缓解率(ORR)为82%,完全缓解率(CR)为58%,中位随访期51.1个月时患者中位总生存期(OS)为25.8个月,4年OS率为44%。
2021年3月,Yescarta再获美国FDA批准,用于治疗既往已接受过2线或以上系统性治疗后复发或难治性滤泡性淋巴瘤(r/r FL)成人患者。根据这项最新批准,Yescarta是第一款被批准用于治疗FL的CAR-T细胞疗法。Yescarta注册临床研究ZUMA-5(NCT03105336)的数据显示,接受Yescarta治疗的复发难治性滤泡性淋巴瘤(r/r FL)患者,总缓解率(ORR)为91%、完全缓解率(CR)为60%,中位随访14.5个月时,中位缓解持续时间(DOR)尚未达到。
原文出处:国家药监局、复星医药集团、复星凯特