今天(2月28日)是第14个“国际罕见病日”。根据世界卫生组织的统计,全球约有6000~8000种罕见病,影响着多达4亿患者的生活。对于罕见病患者,从获得确诊到找到有效疗法,都面临着严峻的挑战。不过在患者组织、研发和监管机构的共同努力之下,罕见病领域的药物(孤儿药)已成为创新疗法开发的亮点之一。
根据最新发布的一份药物临床开发成功率报告:在2011年-2020年,罕见病(不含肿瘤适应症)药物从1期临床到获得美国FDA批准上市的平均成功率为17.0%,高于整体药物的平均开发成功率7.9%。而统计显示,在2020年FDA批准的新药中,孤儿药数量占比也达到了近10年来的新高。
罕见病药物四个开发阶段转化成功率均高于行业平均值
根据报告,研究人员对过去十年(2011年-2020年)在9704个药物临床开发项目中发生的12728个处于过渡阶段的项目(涉及1779家公司)成功率进行了分析,其中有1256个为罕见病药物开发项目。通过计算进入下一阶段的项目数量/(进入下一阶段的项目数量+暂停的项目数量),分析人员对药物开发经历的四个阶段的转化成功率、以及不同疾病领域药物在各个开发阶段的转化成功率进行了评估。
分析发现,罕见病药物从1期临床到2期临床的成功率为67.4%(n=380),2期临床到3期临床的成功率为44.6%(n=464),3期临床到提交新药上市申请(NDA)/生物制品许可申请(BLA)的成功率为60.4%(n=240),从递交NDA/BLA到获得FDA批准的转化成功率为93.6%(n=172)。
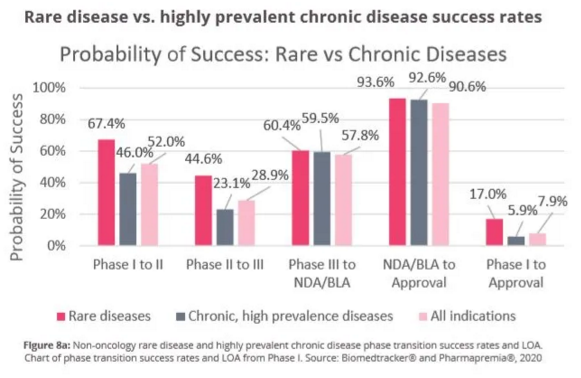
图片来源:参考资料[1]
值得一提的是,罕见病药物这四个阶段的成功率均高于所有疾病领域药物在这四个阶段的平均开发成功率。其中,差异最显著的是2期临床到3期临床的转化成功率(44.6% vs 28.9%),其次是1期临床到2期临床的转化成功率(67.4% vs 52.0%)。
罕见病药物从1期临床到获批的成功率为17.0%
此外,研究人员对罕见病药物从1期临床到获得FDA批准上市的成功率(LOA)也进行了评估。LOA成功率是所有四个临床开发阶段的成功率的乘积。例如,如果每个阶段都有50%的成功率,那么从1期临床阶段到获批的成功率则为0.5 x 0.5 x 0.5 x 0.5 = 6.25%。
根据报告,罕见病药物(不含肿瘤适应症)从1期临床到获得FDA批准的平均成功率为17.0%(n=1256),高于整体药物的平均开发成功率7.9%(n=12728)。这一数值也高于非肿瘤适应症药物的平均成功率(9.3%,n=8549),更是达到了高发慢性病药物的近3倍(5.9%,n=1978)。
同时,研究人员对罕见病中的肿瘤适应症药物开发成功率也做了评估。分析发现,罕见病中的肿瘤适应症药物从1期临床到获得FDA批准的平均成功率为6.8%,也高于非罕见肿瘤适应症(4.4%)。报告指出主要原因之一是血液癌症的发病率通常较低,被归为罕见病,加上血液系统恶性肿瘤的总体开发成功率较高。
2020年,FDA批准的孤儿药数量占比创新高
值得一提的是,在研究人员此前发布的2006年-2015年药物临床开发成功率报告中,罕见病领域药物开发项目只有521个。而在本次分析的2011年-2020年的12728个处于过渡阶段的药物开发项目中,罕见病领域药物开发项目增加至了1256个,共涉及685个不同的药物开发商。报告指出,这说明医药公司对罕见病领域的药物开发已经越来越重视。
这一点也在美国FDA批准的新药中得到了验证。据统计,从2010年-2020年期间,FDA批准的孤儿药数量呈现了稳步上升的趋势。2010年,FDA批准的孤儿药数量仅有6个,而这一数值到2018年已达到了34个。在2020年,FDA批准的孤儿药数量为31个,占全年获批新药总数的58.5%,比值达到了10年来的新高。
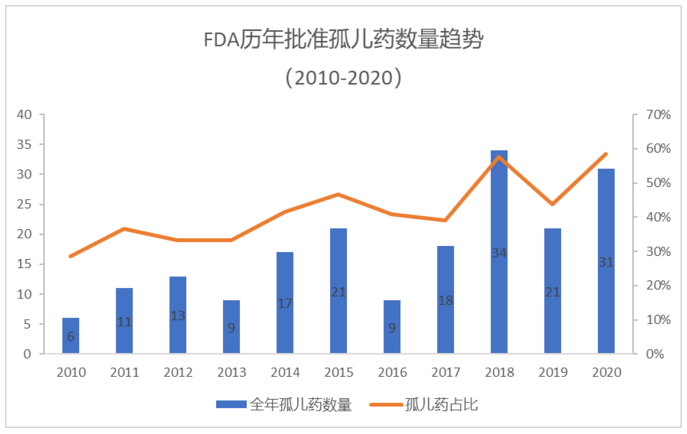
▲2020年FDA批准的孤儿药占比为近10年来最高(药明康德内容团队制图)
相信在社会各界的努力下,将会有越来越多的罕见病药物获批上市,为患者提供新的治疗选择。
相关阅读:
值第14个国际罕见病日之际,药明康德将携手美洲、欧洲、亚洲等多地区的罕见病生态圈的伙伴们,在今天上午10-11点共同发起一场别开生面的纪念活动。以冲破屏障的音乐串联不同地域、不同文化、不同语言的人们,传递“罕见亦众多,罕见亦强大,罕见亦骄傲”的正能量。