
来自哈佛医学院(Harvard Medical School,HMS)的科学家们识别出肌萎缩侧索硬化(ALS)患者中神经细胞损害的关键策动者(instigator)。ALS也被称为卢伽雷氏症,是一种目前无法治愈的进行性神经退行性疾病。
这项研究8月5日发表于《科学》(Science)期刊,研究人员表示,他们的发现可能导向新的疗法以停止这种致命性疾病的发展。在当前研究表明能够停止ALS小鼠中的神经细胞损害后,一种这样的疗法已经在开发用于人类测试。

ALS的发病以神经轴突的逐渐变性退化和最终死亡为标志。神经轴突是神经细胞上纤细的突出部分,负责将信号从一个细胞传输到另一个。
HMS的研究表明,一种被称为RIPK1的酶的异常行为会扰乱髓磷脂(myelin,包裹和隔离轴突,使其免受损伤的柔软凝胶状物质)的生成,损害神经轴突。
“我们的研究不仅阐明了轴突损伤和死亡的机制,还识别出通过抑制RIPK1活性进行反击的可能保护性策略”该研究资深研究员、HMS细胞生物学Elizabeth D. Hay教授袁钧瑛(Junying Yuan)说道。

在过去十年里,袁教授及其同事们已经取得了一系列关键发现,揭示RIPK1作为炎症和细胞死亡的关键调节者。但在这项新研究之前,科学家们尚不清楚RIPK1在轴突死亡和ALS中所扮演的角色。
研究人员在小鼠和人类ALS细胞中进行的实验显示,当RIPK1失去控制时,会引发一种化学连锁反应,最终剥离轴突的保护性髓鞘并触发轴突变性——ALS的标志。
研究人员发现,RIPK1会直接攻击体内髓磷脂生产工厂——被称为少突胶质细胞的神经细胞。少突胶质细胞分泌柔软、富含脂肪和蛋白质的髓磷脂,包裹轴突以支持它们的功能并保护其免受损害。
袁教授实验室之前的工作表明,necrostatin-1能够阻断RIPK1的活性。以此为基础,研究团队在培养皿中测试了ALS细胞可能对同样的治疗做出怎样的反应。necrostatin-1确实在ALS转基因小鼠的细胞中抑制了RIPK1的活性。
在最后一组实验中,研究人员使用necrostatin-1治疗存在轴突损伤和后腿无力(轴突死亡的指示信号,类似于人类ALS早期阶段出现的肌肉无力)的小鼠。Necrostatin-1治疗不仅恢复了轴突的髓鞘并停止轴突损害,而且阻止了四肢无力(的发展)。
连接节点
在初始的实验中,研究人员关注于optineurin(OPTN,视神经蛋白)基因。之前的研究已经表明,OPTN缺陷存在于遗传和散发形式的ALS患者中,但科学家们并不确定OPTN是否以及如何参与疾病发展。为了找到答案,研究人员创造了缺失OPTN的转基因小鼠。通过在显微镜下检查脊髓细胞,他们注意到:与正常小鼠脊髓细胞相比,缺失OPTN基因的小鼠轴突肿胀、发炎,数量也少得多,而且存在髓磷脂降解的迹象。
引人注目的是,研究人员在人类ALS患者的脊髓细胞中发现了相同的轴突死亡迹象。存在OPTN缺陷的小鼠还表现后腿力量丢失。进一步的实验显示,缺失OPTN 对分泌髓磷脂的细胞的损害尤其明显。因此,研究人员得出结论:OPTN缺陷会直接导致神经系统的髓磷脂工厂失能。但仍然存在一个问题:缺失OPTN如何损害这些细胞?
确凿证据
在寻找炎症和细胞死亡中常见化学物质的过程中,研究人员注意到,缺失OPTN的小鼠脊髓细胞中存在异常高水平的RIPK1——已知的细胞死亡促进者。此外,研究人员观察到其他通常被RIPK1召集而杀死细胞的有害化学物质的踪迹。
“就像我们看到了RIPK1及其召集物留下的细胞死亡的化学足迹”袁教授说道。
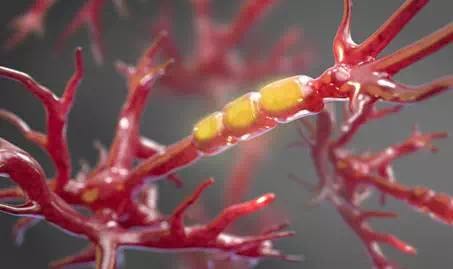
健康神经元的轴突包裹在柔软、凝胶状髓磷脂鞘中。在ALS中,髓鞘被剥离,导致轴突裸露而易损,最终死亡。HMS研究人员发现了轴突死亡过程的一个关键策动者,同时发现了对抗其影响的潜在疗法。
袁教授补充说,这些观察是将RIPK1错误行为与OPTN缺陷相联系的确凿证据。换句话说,研究人员表示,在发挥正常功能时,OPTN基因似乎能够通过确保RIPK1的水平得到控制(快速分解并及时清除出细胞)而调节其行为。如果没有这样的监控,RIPK1会表现得失去控制,并造成损害。
在最后一组实验中,研究人员检查了来自携带SOD1基因突变的ALS小鼠的神经元,发现RIPK1水平也在这些细胞中升高。因此,研究人员表示,OPTN可能不是唯一调节RIPK1行为的基因。相反,RIPK1似乎会促进各种形式遗传和获得性ALS中的轴突损害。
研究结果暗示,RIPK1可能涉及一系列其他神经退行性疾病的轴突损害,包括多发性硬化、某些形式的脊髓性肌萎缩,甚至阿尔茨海默病。
哈佛技术开发办公室(OTD)与合作机构已经开发出一种RIPK1调节化合物的专利组合。哈佛OTD已经将专利授权给一家生物技术公司。
这项研究由美国国家神经疾病和中风研究所(1R01NS082257)和国家衰老研究所(1R01AG047231)提供部分拨款支持,并得到中国国家科技重大项目(2014ZX09102001-002)和中国国家自然科学基金国家重点项目(31530041)的支持。
原文链接:http://hms.harvard.edu/news/agent-demise
--------------------
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。