
智擎生技制药公司(PharmaEngineInc)近日宣布,Perpetual Succour医院已有第一例软组织肉瘤(STS)患者接受了新药PEP503(NBTXR3)的第二/第三期临床试验研究。
这一被称为301研究(与软组织肉瘤治疗相关的多国家、随机、非盲且双组的)的第二/第三期临床试验是与智擎生技制药公司的合作伙伴Nanobiotix S.A公司共同合作开展的。智擎公司是亚太地区301研究的共同主办方。
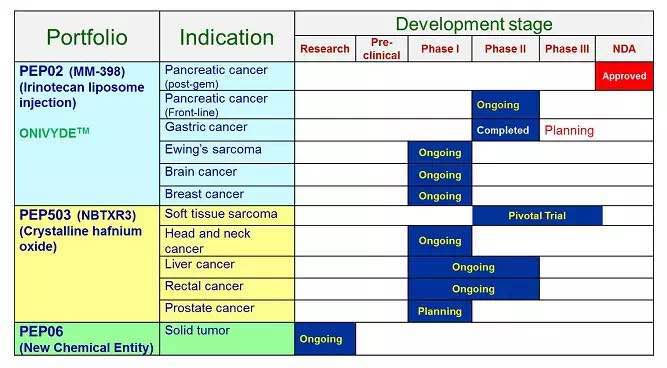
301研究的主要目的是通过瘤内注射PEP503,然后通过体外放疗(EBRT)激活来提高病理性完全反应率(pCR)。301研究的PEP503合并放疗的疗效将与单独放疗的疗效进行比较。
301研究共招募患者约为180人。在欧洲及南非地区,由Nanobiotix公司征募;在亚太地区(澳大利亚、香港特别行政区、菲律宾)则由智擎公司征募。这项全球试验的第一名患者来自欧洲,并于2015年第一季度接受了相应治疗。病人招募现在仍在积极进行中。
主要研究者是来自法国巴黎居里研究所的SylviaBonvalot教授。一旦招募的患者达到三分之二,将进行一次中期的分析来确保参加研究的所有病人的安全性、所收集数据的质量以及研究设计的持续科学有效性。
“作为全球重要STS研究的一部分,我们十分高兴在亚太地区招募到了第一名患者”,C. Grace Yeh博士,智擎公司的主席兼首席执行官说,“Nanobiotix公司在STS以及头颈部癌症的第二/第三期临床试验上所取得的理想结果,鼓励我们加速全球临床开发和加速作为医疗设备的监管注册过程”。
首次接受本项研究的治疗的第一例患者,是一个智擎公司和Nanobiotix公司之间许可与合作协议的发展里程碑。智擎公司将向Nanobiotix支付划时代意义的一百万美金。
关于PEP503(NBTXR3)
PEP503是Nanobiotix公司制剂及药物传输系统中基于纳米X射线(NanoXray)的主要研究项目,它是一种惰性的结晶状纳米铪氧化物,用来局部治疗癌症以提升放疗的效果。
2012年8月智擎公司获得了来自Nanobiotix公司在亚太地区对NBTXR3的研发以及商业化的授权。带着在2015年对抗肿瘤活动的希望前景,Nanobiotix公司在2014年于芝加哥举行的美国临床肿瘤学会(ASCO)年会上报告了NBTXR3试验研究的良好结果和在头颈部癌症研究中的初步安全性结果,即病人可良好地耐受NBTXR3。
另外,Nanobiotix公司在欧洲已开展了肝癌(肝转移癌以及肝细胞肝癌)第一/第二期临床研究并获得了美国食品和药物管理局(FDA)在前列腺癌的第一/第二期临床研究的新药审请许可。智擎公司在台湾地区开始了直肠癌的1b/2期临床研究。PEP503在很多欧洲国家以及一些亚洲国家被归类为三级医疗设备。
关于智擎生技制药股份有限公司

智擎生技制药是一家处于商业化阶段的肿瘤公司,总部设在台湾地区台北市,其全资子公司PharmaEngine Europe Sarl位于法国巴黎。智擎公司致力于开发治疗癌症和亚洲流行疾病的新药。
智擎公司现有三项正在进行的项目,ONIVYDE® (伊立替康脂质体注射液)已获得台湾食品药品监督管理局(TFDA)以及美国食品和药物管理局(FDA)的监管批准,用于治疗用gemcitabine治疗后病情仍然发展的转移性胰腺癌患者,用于软组织肉瘤全球重要临床试验以及直肠癌处1b/2期临床研究的PEP503(NBTXR3),还有PEP06 新药开发。
如需更多资讯内容,请参考智擎公司网站www.pharmaengine.com
原文链接:
--------------------
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。